
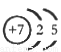
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。

(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq)
+2NH3·H2O(aq)
Mg2+(aq)
+2NH3·H2O(aq)
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
|
实验① |
等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 |
生成白色沉淀 |
|
实验② |
等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 |
无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq) = IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
|
实验编号 |
I—的初始浓度 (mol·L—1) |
ClO—的初始浓度 (mol·L—1) |
OH—的初始浓度 (mol·L—1) |
初始速率v (mol·L—1· s—1) |
|
1 |
2 × 10—3 |
1.5 × 10—3 |
1.00 |
1.8 × 10—4 |
|
2 |
a |
1.5 × 10—3 |
1.00 |
3.6 × 10—4 |
|
3 |
2 × 10—3 |
3 × 10—3 |
2.00 |
1.8 × 10—4 |
|
4 |
4 × 10—3 |
3 × 10—3 |
1.00 |
7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
(1) (2分) (2)HSO3—+
Cl2 +H2O = 3H+ + SO42—+ 2Cl- (3分)
(2分) (2)HSO3—+
Cl2 +H2O = 3H+ + SO42—+ 2Cl- (3分)
(3)2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol (3分)
(4)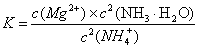 (2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(5)① ClO— 对反应速率的影响 (2分)
② 7.2 × 10—4 (2分)
【解析】
试题分析:(1)根据题意推断,M为N2H4,则1、2分别表示H、N,氮原子的核电荷数为+7,核外电子层结构为25;(2)亚硫酸盐与氯水发生氧化还原反应,生成强酸,反应式为HSO3—+Cl2+H2O=3H++SO42—+2Cl-;(3)读表可知,升高温度,平衡右移,说明正反应是吸热反应;根据原子守恒可知,1/2N2(g)+3/2H2O(l) NH3(g)+3/4O2(g)
△H=+382.5kJ/mol,或2N2(g)
+6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=
NH3(g)+3/4O2(g)
△H=+382.5kJ/mol,或2N2(g)
+6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=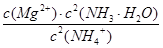 ;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v=7.2 × 10—4 。
;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v=7.2 × 10—4 。
考点:考查物质结构、氧化还原反应、离子方程式、热化学方程式的书写、化学平衡常数的表达式及应用、沉淀的生成、化学反应速率及其影响因素、探究实验方案设计等相关知识。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 取少量该焰火原料, 加入冷水 |
无明显现象 | 合金中不含Li、Na等活泼金属 合金中不含Li、Na等活泼金属 |
| ② | 取少量该焰火原料, 加入足量稀盐酸 |
完全溶解,有大量气体 产生、溶液呈无色 |
含有能与盐酸反应的较活泼的金属 含有能与盐酸反应的较活泼的金属 |



查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(重庆) 题型:实验题
固态化合物A由两种短周期元素组成,可与水放生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。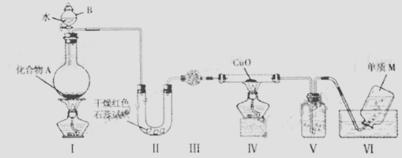
(1)仪器B的名称是____________。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为__________________;Ⅳ发生反应的化学方程式为____________;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ——Ⅱ——Ⅲ——Ⅳ——Ⅴ——Ⅵ,此时Ⅱ 中现象为________,原因是__________________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期末理综化学试卷(解析版) 题型:填空题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A???????? ,E??????????? ,L?????????? ;
(2)在反应①②③④⑤中属于氧化还原反应的是???????????????????????????? ;
(3)反应③化学方程式为:?????????????????????????????????????????????? ;
(4)写出下列离子方程式:反应②???????????????????????????????????????? ;
G溶液与M溶液的反应?????????????????????????????? ?????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com