
【题目】下列叙述中正确的是( )
A.1mol H2O的质量是18g·mol-1B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32克D.标况下1mol乙醇的体积为22.4 L
科目:高中化学 来源: 题型:
【题目】在T℃ 时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ gcm﹣3 , 溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )
A.溶质的质量分数为w= ![]() ×100%
×100%
B.溶质的物质的量浓度c= ![]() ?mol?L﹣1
?mol?L﹣1
C.溶液中c(OH﹣)= ![]() ?mol?L﹣1
?mol?L﹣1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国南海海域是全球范围内石油储量与可开采储量较丰富、开采潜力较大的地方,有“第二个波斯湾”之称.下列关于石油的说法正确的是( )
A.石油属于可再生矿物能源
B.石油只含有碳、氢、氧三种元素
C.石油裂化的主要目的是提高轻质液体燃料的产量和质量
D.石油分馏的各馏分均是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分为MnO2 , 含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。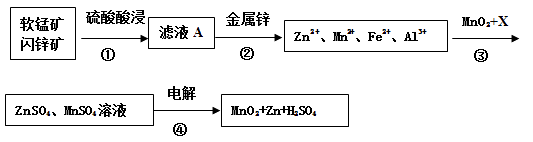
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是。
(3)步骤③中MnO2的作用是 ,另外一种物质X可以是 。
A.ZnO B.MgCO3 C. MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2 , 它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式。
(5)已知:HCN的电离常数K=4.9×10-10 , H2S的电离常数K1=1.3×10―7 , K2=7.0×10―15 , 向NaCN溶液中通入少量的H2S气体,反应的离子方程式为。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究。
【实验原理】有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
【实验用品】2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5%KSCN溶液、pH=4的HAc-NaAC缓冲溶液、1∶1HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 ml容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
【实验过程】
Ⅰ.配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL5%KSCN溶液和2.5 mLpH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
Ⅱ.制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL1∶1 HNO3溶液,小心加热2~3 min。冷却后,全部移入100 mL容量瓶中,再加入4.0 mL5%KSCN溶液和10.0 mLpH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL待测液加入与Ⅰ中相同规格的比色管中。
Ⅲ.比色:将Ⅱ所得比色管中的溶液与Ⅰ中各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显色。
(2)完成该实验,还缺少的仪器有、。
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是?
(4)实验中量取HNO3溶液、HAc-NaAc缓冲溶液用量筒即可,原因是?
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是?
(6)若测得待测液中Fe3+的物质的量浓度为c mol/L,药片的质量为m , 则药片中铁元素的质量分数为?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为10 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是( )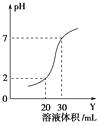
A | B | C | D | |
X浓度/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
Y浓度/mol·L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法中正确的是( )
A.乙烷中混有乙烯,加入氢气在一定条件下充分反应
B.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液
C.除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液
D.溴苯中混有溴,加入KI溶液后,用分液漏斗分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应水化物是已知无机含氧酸中最强的酸。则:
(1)A、B、C、D分别是________、________、________、________。
(2)A的离子结构示意图为________________,C的原子结构示意图为________________。
(3)C的最高价氧化物对应水化物与A的氢氧化物反应生成________种盐,其化学式为________、________、________ (可不填满,也可补充)。
(4)C、D的气态氢化物稳定性由强到弱的顺序是________________ (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com