
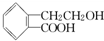 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.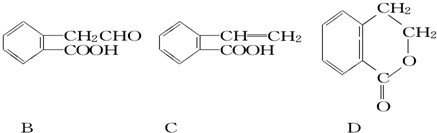
 .
. 科目:高中化学 来源: 题型:解答题
| a | b | ||||||||||||||||
| d | e | f | |||||||||||||||
| c | g | h | |||||||||||||||
| A | B | C | D | ||||||||||||||
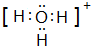
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
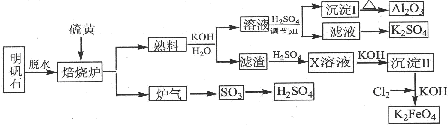
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | Na2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物之间在化学性质上相似 | |
| B. | 同系物之间的物理性质随分子里碳原子数的递增,呈规律性的变化 | |
| C. | 同系物不可能是同分异构体 | |
| D. | 分子组成相差一个或几个CH2原子团的物质互称为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
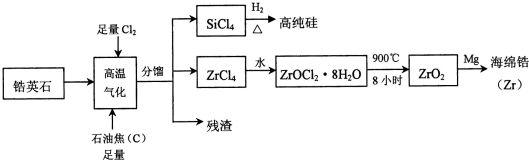
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图装置:用于制取并收集乙酸乙酯 | |
| B. |  如图装置:用于分离两种沸点不同的物质 | |
| C. |  如图装置:收集氨气时,从a口进气b口排气 | |
| D. |  如图装置:可用来快速制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
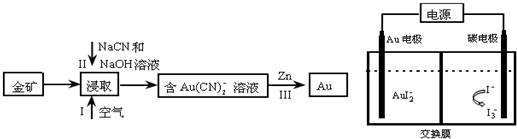
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com