
| a | |||||||
| b | c | d | |||||
| e | f | g | |||||
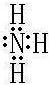 ;碳元素所在周期最高价氧化物的水化物酸性最强的是HNO3.故答案为:
;碳元素所在周期最高价氧化物的水化物酸性最强的是HNO3.故答案为: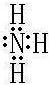 ;HNO3.
;HNO3.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、在吸热反应中,反应物的总能量比生成物的总能量高 |
| B、应用盖斯定律可以计算某些难以测量的反应焓变 |
| C、需要加热的化学反应都是吸热反应 |
| D、盐类的水解反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
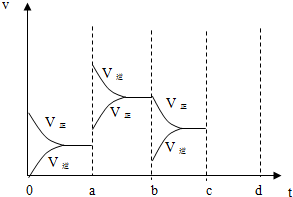
查看答案和解析>>
科目:高中化学 来源: 题型:
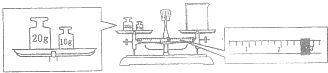
查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:
80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.04 | 0.28 | 0.20 | a | b | c |
| n(NO2) | 0.00 | 0.24 | 0.40 | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com