
【题目】苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈(![]() )为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
)为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
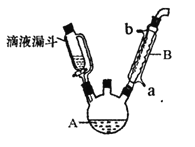
在250mL三口瓶A中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8g苯乙腈,然后升温至130℃,发生反应:
![]() +2H2O+H2SO4
+2H2O+H2SO4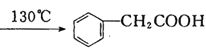 +NH4HSO4
+NH4HSO4
请回答:
(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。
(2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。
(3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。
(4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。
(5)提纯粗苯乙酸最终得到19g纯品,则苯乙酸的产率是_____%(结果保留整数)。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______;写出此步发生反应的化学方程式_______。
【答案】 水浴加热的温度达不到130℃ 放在反应混合液中,但不能接触烧瓶内壁 三口瓶和滴液漏斗中气压相通,液体能顺利滴下 降低温度,减小苯乙酸的溶解度,便于苯乙酸析出 过滤 35 促进苯乙酸的溶解,以利于苯乙酸充分反应 ![]()
【解析】(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。但水浴加热的温度达不到130℃,故老师否定了这个建议;(2)温度计水银球的合理位置是放在反应混合液中,但不能接触烧瓶内壁;(3)滴液漏斗的优点是三口瓶和滴液漏斗中气压相通,液体能顺利滴下;(4) 因为反应混合物中有浓硫酸,所以要将混合物倒入冷水中,反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;苯乙酸从溶液中析出,故分离出苯乙酸的操作是过滤;(5) 由反应![]() +2H2O+H2SO4
+2H2O+H2SO4 +NH4HSO4可知,46.8g苯乙腈生成苯乙酸为46.8g×
+NH4HSO4可知,46.8g苯乙腈生成苯乙酸为46.8g×![]() =54.4g,最终得到19g纯品,则苯乙酸的产率是
=54.4g,最终得到19g纯品,则苯乙酸的产率是![]() ×100%=35%;(6) 苯乙酸微溶于冷水,溶于乙醇,为了充分反应,混合溶剂中加乙醇增大苯乙酸的溶解度,便于充分反应;将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,发生反应的化学方程式为:
×100%=35%;(6) 苯乙酸微溶于冷水,溶于乙醇,为了充分反应,混合溶剂中加乙醇增大苯乙酸的溶解度,便于充分反应;将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,发生反应的化学方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)计算温度为973K时,反应CO2(g)+H2(g)![]() CO(g)+H2O(g) K=__________;
CO(g)+H2O(g) K=__________;
(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
①该反应能够自发进行的原因是___________________________。
②下列措施中能使c(CH3OH)增大的是________。
a.降低温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2________T1(填“>”、“<”或“=”)。
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
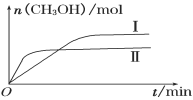
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.以上说法均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
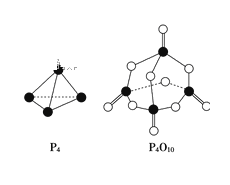
A. (4c+12b-6a-5d) kJ·mol-1 B. (6a+5d-4c-12b) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1 D. (4c+5d-4a-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10.1g某卤代烃与足量NaOH溶液混合,充分反应后,加入足量AgNO3-HNO3混合溶液,生成18.8g浅黄色沉淀。则该卤代烃可能是
A. CH3Br B. CH3CH2Br C. CH2BrCH2Br D. CH3CHBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由核电荷数1~18的某些元素组成的单质 A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示的转换关系,A是地壳中含量最多的金属元素。 请回答下列问题:

(1)写出下列物质的化学式:乙__________、丁__________、戊__________.
(2)写出甲物质在工业上的一种主要用途:__________。
(3)写出甲→乙+丙反应的离子方程式:__________。
(4)A→乙+C反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
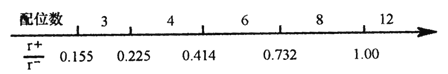
已知在某AB型离子化合物中,A+离子的半径为84pm,B-离子的半径为140pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:

则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )

A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是(______)(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)下图是从海水中提取镁的简单流程。

①操作A是 _______________________。
②无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_____。
③海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?____。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是(________)(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________________。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是(________)(填字母序号)。
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:_______。
(4)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH = K2CO3+3H2O,则该燃料电池的负极的电极反应为__________________。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率_________(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________mol/L。
③能够说明该反应达到化学平衡状态的标志是_______(双选)。
A.单位时间内消耗1molCO2,同时生成3mol H2
B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化
D.CH3OH和H2O浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com