
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
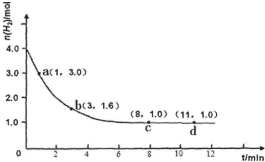 工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.
工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.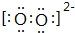 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该同学的实验目的是分离氯化钠、氯化钙 | |
| B. | 上图括号内的操作步骤均为加热蒸发 | |
| C. | 按此实验方案可得到较纯净的NaCl固体 | |
| D. | 按此实验方案可得到较纯净的CaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 比较项 | 依据的化学反应事实 | |
| A | 比较Cl和S的非金属性 | Na2S+2HCl=2NaCl+H2S↑ |
| B | 比较Fe2+和Br-的还原性 | 2FeBr2+3Cl2(过量)=2FeCl3+2Br2 |
| C | 比较氯化银和碘化银溶解度 | AgCl(s)+I-少量(aq)=AgI(s)+Cl-(aq) |
| D | 比较硝酸和硫酸的酸性 | 3Cu+8HNO3(稀)═3Cu(NO3)2+4H2O+2NO↑ Cu和H2SO4(稀)不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$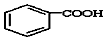
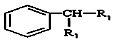
 (-R1、R2表示氢原子或烃基)
(-R1、R2表示氢原子或烃基) ,C的结构简式为CH3CH2OH,
,C的结构简式为CH3CH2OH,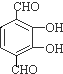 、
、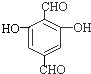 .
. ,反应类型是取代反应.
,反应类型是取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com