
【题目】中国女药学家屠呦呦因研制新型抗疟青蒿素和双氢青蒿素成果而获得2015年诺贝尔生理学或医学奖。青蒿素和双氧青蒿素结构如图所示。下列关于青蒿素和双氢青蒿素的说法正确的是( )
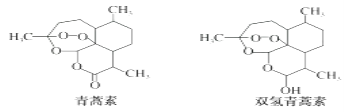
A. 青蒿素的分子式为C15H22O5B. 青蒿素和双氢青蒿素是同分异构体
C. 青蒿素和双氢青蒿素都能发生酯化反应 D. 双氢青蒿素在水中的溶解性小于青蒿素
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有浓度为0.1mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1、b mol·L-1、cmol·L-1,大小顺序为 ______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,生成的盐的物质的量依次为n1mol、n2mol、n3mol,它们的大小关系为 ______。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3 L,其大小关系为 ______。
(4)与等量锌反应时产生氢气![]() 的速率分别为v1、v2、v3,其大小关系为 ______。
的速率分别为v1、v2、v3,其大小关系为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
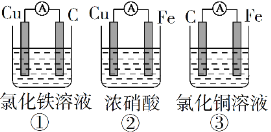
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
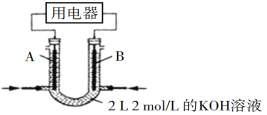
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为___________, 其中氮的化合价为___________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为____________.
(3)①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4=______________, 联氨和N2O4可作为火箭推进剂的主要原因为______________________.
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为_____ (已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为_______________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______________. 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2__________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,有关反应焓变的判断正确的是( )
C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
A. ΔH1>0,ΔH3<0 B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3 D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的反应原理,不正确的是
A. 铝热法炼铁:Fe2O3 + 2Al 高温Al2O3 + 2Fe
B. 火法炼铜:Cu2S + O2 高温2Cu + SO2
C. 电解法制钠:2NaCl(熔融) 电解2Na + Cl2↑
D. 电解法制镁:2MgO(熔融) 电解2Mg + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
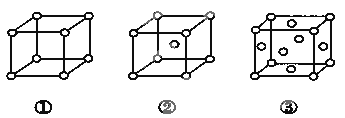
A. ①、②、③依次为简单立方堆积、六方最密堆积、体心立方堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③6个
C. 晶胞中原子的配位数分别为:①6, ②8 ,③12
D. 空间利用率的大小关系为:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图是全钒液流电池的示意图
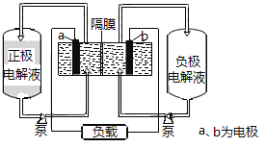
该电池充放电的总反应式为:![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。
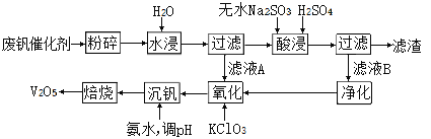
(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com