
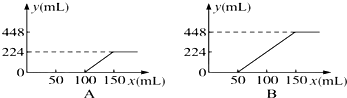
| A����A����£�������NaOH��Na2CO3�Ļ��������ʵ���֮��Ϊ2��1 |
| B����B����£�������Na2CO3��NaHCO3�Ļ��������ʵ���֮��Ϊ1��2 |
| C����B����£�����ֻ��Na2CO3 |
| D��ԭNaOH��Һ�����ʵ���Ũ��Ϊ1.5 mol/L |
| 0.448 |
| 22.4 |
| 0.03mol |
| 0.02L |


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 һ�������£���Һ������Զ�TiO2���ȼ��R���ⷴӦ��Ӱ����ͼ��ʾ����ش��������⣺
һ�������£���Һ������Զ�TiO2���ȼ��R���ⷴӦ��Ӱ����ͼ��ʾ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| KW |
| A��NaOH |
| B��NaHSO4 |
| C��NH4NO3 |
| D��KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��25��ʱ����0.1mol/L��ˮ��Һ��
| ||
B��25��ʱ����0.1mol/L������Һ��ˮϡ�ͣ������¶Ȳ��䣬ϡ������
| ||
| C��0.1mol/L��Na2CO3��Һ�У�c��OH-��-c��H+��=c��HCO3-��+2c��H2CO3�� | ||
| D��Ũ�Ⱦ�Ϊ0.1mol/L�İ�ˮ��Һ��NH4Cl��Һ�������Ϻ�����Һ�ʼ��ԣ���������Һ�У�c��NH4+����c��NH3?H2O����c��Cl-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���屽�л����壬����KI��Һ��������������ȡ |
| B���������л���Ũ�����Ũ���ᣬ���䵹�뵽NaOH��Һ�У����ã���Һ |
| C�������л�����ϩ��ͨ������һ�������·�Ӧ��ʹ��ϩת��Ϊ���� |
| D����ϩ�л���SO2��CO2�������Ⱥ�ͨ��NaOH��KMnO4��Һ��ϴ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ʵ | ���� |
| A����ȫȼ�ղ�����CO2��H2O������ | һ��ֻ��C��HԪ�� |
| B��������֯Ʒ����ë���͵������� | ���ս���ë��ζ������ë�� |
| C���ڵ�����Һ�м������۵ļӵ�ʳ�β�������ɫ | ����˵�����β����� |
| D�������������ʣ���Է���������ͬ���ṹ��ͬ | ����һ����ͬ���칹�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�Ӱ뾶��Mg��K |
| B���ǽ����ԣ�O��S |
| C���ȶ��ԣ�HCl��HBr |
| D�����ԣ�NaOH��KOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CaO+H2O�TCa��OH��2 | ||||
B��C+H2O
| ||||
| C��NaOH+HCl�TNaCl+H2O | ||||
D��2Mg+CO2
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����a��b=10��3����R�Ļ�ѧʽΪFe2O3 | ||
| B����a��b=29��3����R�Ļ�ѧʽΪFe3O4 | ||
| C����a��b=9��32����R�Ļ�ѧʽΪFeO | ||
D��ʵ������б���ԭ��Cl2Ϊ
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com