
| A、若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY |
| B、若a=b,并测得c(X-)=c(Y-)+c(HY);则相同浓度时,酸性HX>HY |
| C、若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY |
| D、若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol?L-1,则可推出a+b=0.2mol?L-1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②③ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、导致青岛开发区石油管线爆炸的非甲烷总烃在日光照射下会产生光化学烟雾 |
| B、塑化剂是一种应用很广的化工塑料软化剂,可大量添加到婴幼儿玩具中 |
| C、航天员太空实验能够证明水分子组成和结构在太空中发生改变 |
| D、汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在无色透明溶液中:Al3+、Na+、HCO3-、Cl- |
| B、在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I- |
| C、加入铝粉放出氢气的溶液:K+、Ca2+、NO3-、SO42- |
| D、在水电离产生的H+的浓度为1×10-13mol?L-1的溶液:Cu2+、Na+、NO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH |
| B、亚硫酸能使酸性高锰酸钾溶液褪色,而碳酸不能 |
| C、同温下,等浓度的亚硫酸氢钠和碳酸氢钠溶液,碳酸氢钠溶液的碱性强 |
| D、将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体能使澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中氯气物质的量为0.04mol |
| B、混合气体中SO2物质的量为0.04mol |
| C、所得的沉淀为0.1mol BaSO4 |
| D、a的取值范围为0.896<a<1.792 |
查看答案和解析>>
科目:高中化学 来源: 题型:

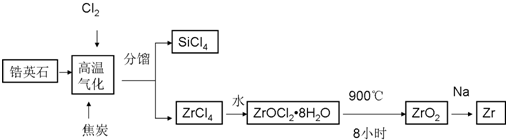
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com