
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 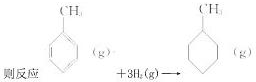 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |


科目:高中化学 来源: 题型:
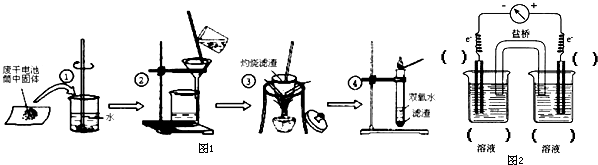
查看答案和解析>>
科目:高中化学 来源: 题型:
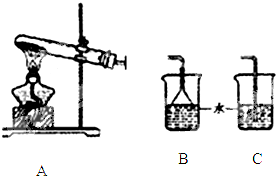 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
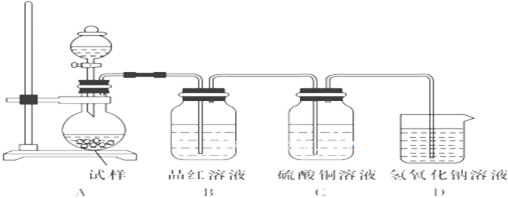
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者的原料来源相同 |
| B、两者的生产原理相同 |
| C、两者对食盐利用率不同 |
| D、两者最终产品都是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不含NO3-,也不含Fe3+ |
| B、含有NO3-、I-、Cl? |
| C、含I-,且肯定含有Cl- |
| D、可能含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com