
| A. | 因地制宜开发利用风能、水能、地热能、潮汐能 | |
| B. | 大力推广并充分利用太阳能 | |
| C. | 合理、安全开发利用氢能、核能 | |
| D. | 能源都是通过化学反应获得的 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 配平后水的化学计量数为4 | |
| B. | 反应后溶液呈酸性 | |
| C. | 配平后氧化剂与还原剂的物质的量之比为3:28 | |
| D. | 氧化产物为AsO43-和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔、沸点逐渐降低 | B. | 单质的氧化性逐渐减弱 | ||
| C. | 阴离子的还原性逐渐减弱 | D. | 气态氢化物稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.01 mol•L-1的醋酸和硫酸溶液中分别加入足量锌片,生成H2的起始速率相等 | |
| B. | 0.1 mol•L-1的NaHCO3溶液中:[Na+]=[HCO3-]+[CO32-]+[H2CO3] | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] | |
| D. | 将0.1 mol的CH3COOH和0.1 mol的CH3COONa溶于水中,配成1L混合溶液.测得溶液的pH<7,则混合液中[CH3COO-]<[Na+] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
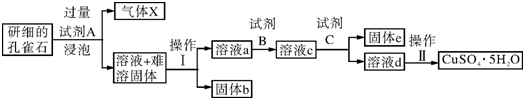
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com