
下列离子方程式不正确的是( )
A.醋酸溶液中加入少量氢氧化镁固体:Mg(OH)2+2CH3COOH===Mg2++2CH3COO-+2H2O
B.H2O2溶液中加入足量酸性KMnO4溶液:2MnO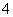 +3H2O2+6H+===2Mn2++6H2O+4O2↑
+3H2O2+6H+===2Mn2++6H2O+4O2↑
C.Ca(HCO3)2溶液中加入足量澄清石灰水:Ca2++HCO +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO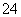 恰好沉淀完全:NH
恰好沉淀完全:NH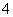 +H++SO
+H++SO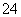 +Ba2++2OH-===NH3·H2O+BaSO4↓+H2O
+Ba2++2OH-===NH3·H2O+BaSO4↓+H2O
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
50 g镁、锌、铝的混合物与适量的稀硫酸反应,得三种盐的混合溶液,然后加热、蒸发、结晶得晶体(不含结晶水)218 g,则反应中得H2的质量为( )
A、2 g
B、3 g
C、3.5 g
D、4.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
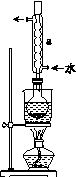
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)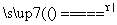 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O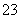 +I2===S4O
+I2===S4O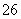 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
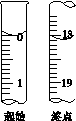
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
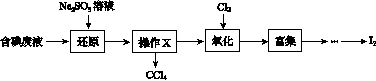
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;该操作将I2还原为I-的目的是______________________。
(2)操作X的名称为________。
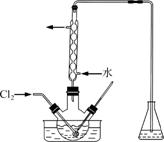
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________;锥形瓶里盛放的溶液为________。
(4)已知:5SO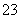 +2IO
+2IO +2H+===I2+5SO
+2H+===I2+5SO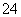 +H2O
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型见图。下列关于水的说法正确的是( )

A.水是弱电解质
B.可燃冰是可以燃烧的水
C.氢氧两种元素只能组成水
D.0 ℃时冰的密度比液态水的密度大
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:__________________________________________。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S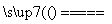 6Cu+SO2。该反应中的氧化剂是____________;当生成19.2 g Cu时,反应中转移的电子的物质的量为________________________________________________________________________mol。
6Cu+SO2。该反应中的氧化剂是____________;当生成19.2 g Cu时,反应中转移的电子的物质的量为________________________________________________________________________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:______________________________________________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式:____________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,平均消耗c mol/L Na2S2O3溶液的体积为V mL。则试样中CuSO4·5H2O的质量分数为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列情况能发生消去反应的是( )
A.1-溴丙烷与NaOH醇溶液共热
B.氯乙烷与NaOH的水溶液共热
C.乙醇与浓H2SO4共热至140℃
D.乙醇与浓H2SO4共热至170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
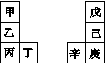
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com