
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
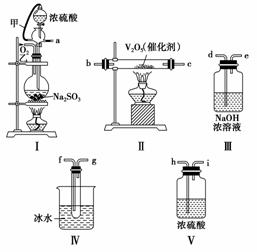
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
解析 (1)依据题中信息,装置的连接顺序是a→h→i→b(c)→c(b)→f→g→d。(2)原理:平衡压强,使分液漏斗和烧瓶内气压相同;作用:使浓硫酸能顺利流下。(3)为使SO2的转化率提高,应先加热Ⅱ中催化剂,再向Ⅰ中滴入浓硫酸。(4)Ⅳ处观察到的现象为试管底部有固体生成。(5)在Ⅰ处大火加热,SO2的转化率会减小。(6)依据转化率公式,即可求出SO2的转化率。
答案 (1)a h i b(c) c(b) f g d
(2)作用:使浓硫酸能顺利流下;原理:平衡压强,使分液漏斗和烧瓶气压相同
(3)先加热Ⅱ中催化剂,再向Ⅰ中滴入浓硫酸
(4)试管底部有固体生成 (5)减小
(6)(1-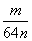 )×100%
)×100%


科目:高中化学 来源: 题型:
目前钢铁是日常生活中使用最广泛的金属,下列关于铁的一些说法正确的是( )。
A.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
D.Fe3O4溶解于盐酸既有FeCl2又有FeCl3生成,故Fe3O4属于混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极按如图中装置完成实验,其中A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A烧杯溶液中NaOH的质量分数为10.23%。试回答下列问题:
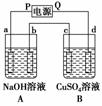
(1)电源的P极为________极。
(2)b极产生气体的体积为________L(标准状况)。
(3)c极上析出沉淀的质量为________g。
(4)d极上所发生的电极反应为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法中,正确的是
( )
A.二氧化硅溶于水生成硅酸,所以二氧化硅属于酸性氧化物
B.将二氧化碳通入硅酸钠溶液中可以得到硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.水晶是比较纯净的二氧化硅,沙子的主要成分是硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)可用于镀锡工业。某小组设计SnSO4制备路线为
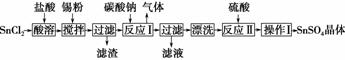
查阅资料:
Ⅰ.锡在酸性溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)锡原子的核电荷数为50,与碳元素同处 ⅣA族,锡位于周期表的第________周期。
(2)操作Ⅰ是 ________、过滤和洗涤等。
(3)溶解SnCl2粉末时需加浓盐酸,原因为__________________________________________________________。
(4)加入Sn粉的作用为①调节溶液pH,②__________________________________________________________。
(5)反应Ⅰ所得沉淀是SnO,其化学反应方程式:__________________________________________________________。
(6)酸性条件下,SnSO4与双氧水反应的离子方程式:__________________________________________________________。
(7)该小组通过下列方法可测定该锡粉的纯度:
①将试样溶于盐酸,反应为Sn+2HCl===SnCl2+H2↑
②加入过量的FeCl3
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,再计算锡粉的纯度,请配平反应:
FeCl2+____K2Cr2O7+____HCl===____FeCl3+____KCl+____CrCl3+____
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表述正确的是________(填序号)。
①(四川理综,4D)将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
②(天津理综,3B)NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
③(重庆理综,3D)25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
④(安徽理综,12D)溶解度小的沉淀易向溶解度更小的沉淀转化,ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
⑤(江苏,11C)加热0.1 mol·L-1 Na2CO3溶液,CO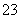 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
⑥(北京理综,9A)测0.1 mol·L-1氨水的pH为11:NH3·H2ONH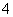 +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。下列说法错误的是( )
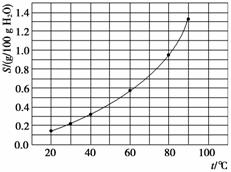
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
美国《探索》杂志报道:科学家对加拿大安大略湖北部的湖泊进行了研究,科学家们最终证实使死区“起死回生”的关键性因素是控制湖泊流域中的磷含量。综合上述信息,下列说法正确的是( )
①赤潮与水华都与氮、磷的富营养化有关 ②海藻降解时会消耗水体中的氧气,导致水体缺氧,水生动物死亡 ③早期使用的洗衣粉中添加的“Na5P3O10”,能除去自来水中的Ca2+和Mg2+等 ④有科学家提出在南极播种铁质,促进藻类大量繁殖,其研究目的可能是扼制温室气体的增加
A.①②③④ B.①④
C.②③ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com