
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
分析 11.2L(标准状况)氯气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,根据得失电子守恒和氯原子守恒分析解答.
解答 解:11.2L(标准状况)氯气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,因为:0.7molKCl、0.2molKClO,根据氯守恒,所以X的物质的量为:0.5×2-0.7-0.2=0.1mol,
设X中Cl的化合价为x价,
由电子得失守恒分析可知:0.7×1=0.2×1+0.1x,即x=5,所以X中氯的化合价为+5价,则X为KClO3,物质的量为0.1mol,
故选B.
点评 本题考查混合物反应的计算、氧化还原反应,题目难度中等,明确得失电子守恒和氯守恒为解答关键,试题培养了学生的化学计算能力.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
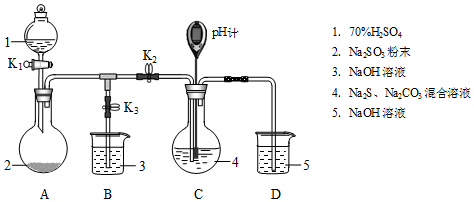
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): S2-+H2O?HS-+OH- |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少); ⅱ.pH计读数逐渐 减小 | 反应分步进行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3 | / | 必须立即停止通SO2的原因是: SO2过量会使溶液酸度增加,使产物分解,降低产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
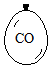 在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )
在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )| A. |  | B. | 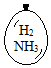 | C. | 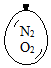 | D. | 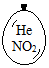 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com