
 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.分析 (1)①N2(g)+O2(g)═2NO(g)△H1
②2C(s)+O2(g)═2CO(g)△H2
③C(s)+O2(g)═CO2(g)△H3,2×③-①-②得,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=2△H3-△H1-△H2,据此进行分析;
(2)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
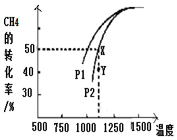
(3)温度一定时,增大压强平衡逆向移动,甲烷的转化率减小;Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡;
(4)依据亚硝酸根离子水解平衡常数表达式变式计算分析.
解答 解:(1)①N2(g)+O2(g)═2NO(g)△H1
②2C(s)+O2(g)═2CO(g)△H2
③C(s)+O2(g)═CO2(g)△H3,2×③-①-②得,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=2△H3-△H1-△H2,
故答案为:2△H3-△H1-△H2;
(2)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC,
故答案为:加热;
(3)温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小,故压强P1<P2;理由是温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小;Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡,则v(正)>v(逆),
故答案为:小于;温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小;大于;
(4)NO2-+H2O?HNO2+OH-,Kh=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$,则Kw=Kh×Ka=5.0×10-11mol•L-1×9.6×10-4mol•L-1=4.8×10-14,
故答案为:4.8×10-14.
点评 本题考查了反应热的计算、化学平衡的调控作用、影响平衡移动及离子积常数的计算,注意知识的归纳和整理是关键,题目难度中等.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Br—Br | H—Br |
键能/(kJ·mol-1) | 436 | 193 | 366 |
请计算H2(g)+Br2(g)==2HBr(g)的反应热( )
A.+103 kJ·mol-1 B.+679 kJ·mol-1 C.-103 kJ·mol-1 D.+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定条件下一定能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl-、HCO3-
B.无色溶液中:Al3+、NH4+、Cl-、HCO3-
C.pH=1的溶液中:ClO-、SO42-、Fe2+、K+
D.由水电离的c(OH-)=10-14mol· L-1的溶液中:CH3COO-、SO42-、Na+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| C. | 水中的钢闸门连接电源的负极,属于外加电流的阴极保护法 | |
| D. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在熔融状态下能导电,所以铁是电解质 | |
| B. | 氯化氢在熔融状态下不导电,所以氯化氢是非电解质 | |
| C. | 氯气的水溶液能导电,所以氯气是电解质 | |
| D. | 电解质和非电解质都是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释、结论 |
| A | 长期露置于潮湿空气中的Fe粉中加入足量的稀盐酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀盐酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入浓硝酸中 | 无现象 | Al在浓硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到蓝色石蕊试纸上 | 试纸变红色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅣA族元素氢化物沸点:SiH4>CH4,所以ⅤA族元素氢化物沸点:PH3>NH3 | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,第三周期元素氢化物稳定性:HCl>H2S | |
| C. | ⅦA族元素的非金属性:F>Cl,所以ⅦA族元素氢化物的酸性:HF<HCl | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com