
【题目】苯乙酸铜是合成优良催化剂、传感材料﹣﹣纳米氧化铜的重要前驱体之一。
如图1是它的一种实验室合成路线:
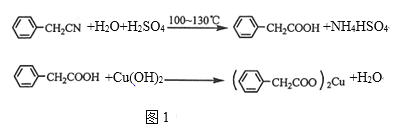
制备苯乙酸的装置如图2所示(加热和夹持装置等略):
已知:苯乙酸的熔点76.5℃,微溶于冷水,溶于热水、乙醇。
回答下列问题
(1)在250mL三口瓶a中加入70mL70%硫酸,将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。
①在装置中,仪器b的作用是_______。
②仪器c的名称是_________,其作用是_______。
③反应结束后与适量冷水混合,混合的操作是_______,与冷水混合的目的是______。
(2)下列仪器中可用于分离苯乙酸粗品的是__________(填字母)。
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯苯乙酸的方法是:将苯乙酸粗产品加入到______进行溶解,然后_____,最后____。最终得到44g纯品,则苯乙酸的产率是_______。
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是__________。
【答案】滴加苯乙腈 球形冷凝管 使反应物冷凝回流(或使气化的反应液冷凝) 把反应混合液沿烧杯内壁(或玻璃棒)倒入装有冷水的烧杯中,并用玻璃棒不断搅拌 便于苯乙酸析出 BCE 热水中 冷却结晶 过滤 95% 增大苯乙酸溶解度,便于充分反应
【解析】
(1)①仪器b可加入反应液;
②由图可知,c为冷凝管,使气化的液体冷凝回流;
③因为反应混合物中有浓硫酸,所以要将混合物倒入冷水中,反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度;
(2)分离苯乙酸粗品,利用过滤操作;
(3)苯乙酸微溶于冷水,在水中的溶解度较小,用重结晶的方法进行提纯;由反应![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×![]() =46.5g,根据产率=
=46.5g,根据产率=![]() ×100%计算;
×100%计算;
(4)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度。
(1)①仪器b的作用为滴加苯乙腈;
②由图可知,c为球形冷凝管,其作用为回流(或使气化的反应液冷凝);
③因为反应混合物中有浓硫酸,所以要将混合物倒入冷水中,反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;
(2)分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒,故答案为BCE;
(3)苯乙酸微溶于冷水,在水中的溶解度较小,则提纯苯乙酸的方法是重结晶,将苯乙酸粗产品加入到 热水中进行溶解,然后冷却结晶,最后过滤;由反应![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×![]() =46.5g,最终得到44g纯品,则苯乙酸的产率是
=46.5g,最终得到44g纯品,则苯乙酸的产率是![]() ×100%=95%;
×100%=95%;
(4)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,即混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应。


科目:高中化学 来源: 题型:
【题目】中央电视台报道联华超市在售的某品牌鸡蛋为“橡皮弹”,专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如图:下列说法不正确的是( )
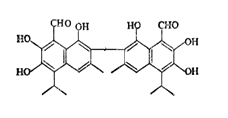
A. 该化合物的分子式为:C30H30O8
B. 1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C. 在一定条件下,可与乙酸反应生成酯类物质
D. 该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种有机合成中间体,一种合成路线如下:
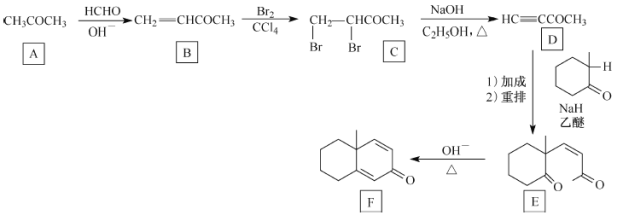
回答下列问题:
(1)A的化学名称为_________________。
(2)B生成C的反应类型为______________,C生成D的反应类型为______________。
(3)F的分子式为_____________,F中所含官能团的名称是____________________。
(4)化合物X与E互为同分异构体,X能与FeCl3溶液发生显色反应,核磁共振氢谱有5组峰且面积比为9:2:2:2:l。写出2种符合要求的X的结构简式:______________________________。
(5)肉桂醛( ![]() )是重要的香精香料中间体,设计由苯甲醇和乙醛为起始原料制备肉桂醛的合成路线:_______________________________________________。(无机试剂任选)。
)是重要的香精香料中间体,设计由苯甲醇和乙醛为起始原料制备肉桂醛的合成路线:_______________________________________________。(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=________________。
(2)为减少SO2的排放,常将煤转化为清洁气体燃料:
已知:H2(g)+ ![]() O2(g) =H2O(g) △H= -241.8kJ·mol-1
O2(g) =H2O(g) △H= -241.8kJ·mol-1
C(s)+ ![]() O2(g) =CO(g) △H = -110.5kJ·mol-1
O2(g) =CO(g) △H = -110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_________________________________________________。
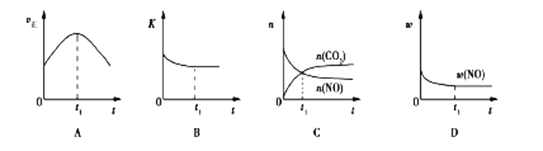
(3)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=______________________;若T1<T2,则该反应的△H _____0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验法是学习化学的重要方法。
Ⅰ.海带中含有丰富的碘元素,以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2I-+Cl2=2Cl-+I2,碘与溴一样易溶于有机溶剂):
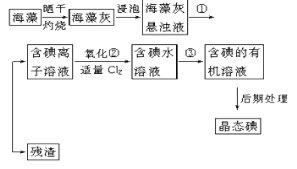
(1)实验操作①的名称:___。
(2)实验步骤②中加适量Cl2的目的__。
(3)实验步骤③提取碘的过程中,不能选用的溶剂是__。
A.苯 B.酒精 C.四氯化碳
(4)从海藻开始经过5步操作到含碘的有机溶液的实验过程中,要用到多种实验仪器。已知实验室里有坩埚、坩埚钳、烧杯、玻璃棒、酒精灯、石棉网、以及必要的夹持仪器等物品,尚缺少的玻璃仪器是___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些常见物质间互相转化的关系图(部分反应条件已省略)。已知A、B、X、Y均为无色气体,E、F为常见单质。
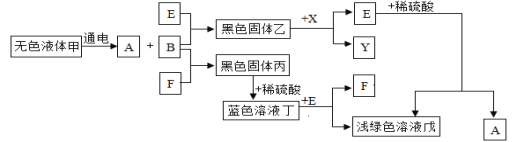
请回答:
(1)写出下列物质的化学式:F__、戊__。
(2)写出下列转化的化学方程式:
①甲→A+B___;
②乙+X→E+Y___。
(3)说出蓝色溶液丁中溶质的一种用途___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将 0. 1mol·L-1的烧碱溶液不断滴加到 10.00 mL 相同浓度的 HA 溶液中,溶液中-lgc水 (H+)与NaOH 溶液的体积关系如图所示[注:c水(H+)为溶液中水电离的(H+)],下列说法不正确的是
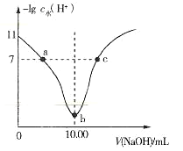
A.0.1 mol · L-1 HA 溶液pH=3
B.b 点溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c 三点溶液中,a 点溶液导电性最强
D.a、c 两点溶液中均存在:c(H+)+ c(Na+) = c(OH-)+ c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.2%的盐酸(密度为1.16gcm-3)配置1.0molL-1的稀盐酸。现实验室需要这种稀盐酸220mL,试回答下列问题:
(1)配置稀盐酸时,应选用容积为___________mL的容量瓶。
(2)经计算需要___________mL浓盐酸,在量取时宜选用下列量筒中的___________。
A.2mL B.10mL C.22mL D.20mL
(3)在量取浓盐酸后,进行了下列操作:
①待稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线12cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的是顺序是(填序号)___________。
(4)在上述配制过程中,用刚刚洗涤洁净还有少量筒来量取浓盐酸,其配制的稀盐酸浓度_______(填“偏高”“偏低”或“无影响”,下同)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶则配制的稀盐酸浓度___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的一种或几种所组成的物质。已知A分子中含有18个电子,C、D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是
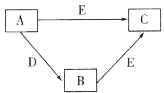
A.Y的简单氢化物的沸点比Z的高
B.X、Y组成的化合物中可能含有非极性键
C.Z的氧化物对应水化物的酸性比W的弱
D.W是所在周期中原子半径最小的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com