
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH 溶液中,由水电离的OH-离子数目为0.1NA
溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3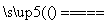 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明 显现象;
显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是__________________;
(2)E是________,判断依据是__________________;
(3)写出下列四种化合物的化学式:A____________、C____________、D____________、F____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+ 、Na+、Fe2+、MnO4-
、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D .K+、NH4+、OH-、SO42-
.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是 ( )
A.Na+、Ba2+、NO 、CO
、CO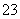
B.Ba2+、K+、Cl-、NO
C.Mg2+、NH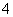 、SO
、SO 、Cl-
、Cl-
D.Fe2+、Na+、SO 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下V L氨气溶解在1 L水中(水的密度近似为1  g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
A.ρ=(17V+22400)/(22.4+22.4V)
B.ω=17c/(1000ρ)
C.ω=17V/(17V+22400)
D.c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
A.给容量瓶检漏时,向容量瓶中注入适量水,左手托住瓶底右手食指顶住瓶塞,倒置数次,观察是否漏水
B.具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
C.中和滴定用的锥形瓶中含有少量水,不影响测定结果
D.配制稀硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=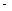 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=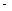 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
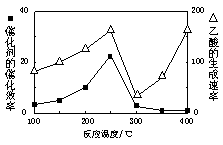
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com