
【题目】某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:
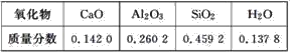
根据表中的数据请写出
(1)该硅酸盐的普通化学式是______________。
(2)用氧化物的形式表示该硅酸盐的组成是____________________。
【答案】CaAl2Si3O10·3H2O(或CaAl2H6Si3O13) CaO·Al2O3·3SiO2·3H2O
【解析】
根据氧化物的质量可求出氧化物的个数比,根据个数比可求出普通化学式。
(1)由各氧化物的质量分数,可求出它们的物质的量之比为n(CaO):n(Al2O3):n(SiO2):n(H2O)=![]() :
:![]() :
:![]() :
:![]() =1∶1∶3∶3,即Ca、Al、Si、O、H的个数之比为1∶2∶3∶13∶6,所以该硅酸盐的普通化学式是CaAl2H6Si3O13;
=1∶1∶3∶3,即Ca、Al、Si、O、H的个数之比为1∶2∶3∶13∶6,所以该硅酸盐的普通化学式是CaAl2H6Si3O13;
(2)用氧化物的形式表示该硅酸盐的组成,按照书写规则,先写活泼金属氧化物,再写较活泼金属氧化物,然后写二氧化硅,最后写水,即为CaO·Al2O3·3SiO2·3H2O。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液中CH3COOH+NH3= CH3COONH4
B.氢氧化钠与氯化铵溶液混合加热:![]() +OH-= NH3·H2O
+OH-= NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=![]() +H2O
+H2O
D.硫酸铵与氢氧化钡溶液:![]() +OH-= NH3·H2O
+OH-= NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
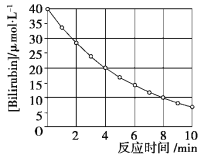
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用足量的MnO2和含有4 mol溶质的浓盐酸充分反应制氯气,下列说法正确的是( )
A. 该实验中共消耗1 mol MnO2,生成1 mol氯气
B. 为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C. 在该反应中MnO2作氧化剂,浓盐酸作还原剂
D. 氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
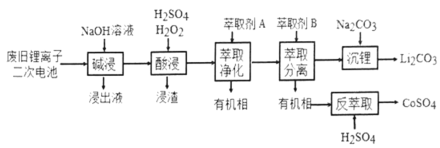
回答下列问题:
(1)“碱浸”目的是___________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
(3)“萃取净化”除去的杂质离子有![]() 外,还有__________。
外,还有__________。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,pH一般选择5左右,理由是______________。

(5)“沉锂”中![]() 溶解度随温度变化曲线如下图所示:
溶解度随温度变化曲线如下图所示:
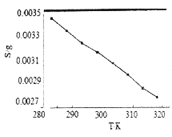
①根据平衡移动原理分析![]() 在水中溶解度随温度变化的原因____________________。
在水中溶解度随温度变化的原因____________________。
②为获得高纯![]() ,提纯操作依次为趁热过滤、________、烘干。
,提纯操作依次为趁热过滤、________、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
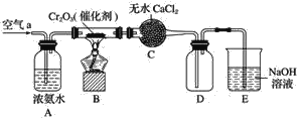
(1)B中发生反应的化学方程式是________________________________。
(2)证明氨气发生了催化氧化的现象是____________________________。
(3)写出(2)中反应的化学方程式______________________。
(4)装置E作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对生铁片锈蚀对比实验的分析正确的是( )
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A.对比实验①②③,说明苯能隔绝O2
B.实验①中,生铁片未见明显锈蚀的主要原因是缺少O2
C.实验②中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
D.实验③中,属于铁的吸氧腐蚀,负极反应:O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列关于工业合成氨的说法不正确的是_______
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)= v逆(H2)
c.容器内压强保持不变 d.合气体的密度保持不变
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
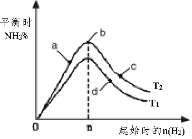
①图象中T2和T1的关系是:T2 __________T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是______(填字母)。
(4)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=___________。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为______mol。
2NH3(g)△H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为______mol。
(5)已知:N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol
2NH3(g)△H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com