
| A、c(H)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- |
| B、由水电离出的c (OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C、含大量Al3+的溶液中:K+、Na+、SO32-、ClO- |
| D、无色溶液中:K+、Na+、MnO4-、SO42- |


科目:高中化学 来源: 题型:
 右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.
右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- |
| C、滴入甲基橙指示剂呈红色的溶液中:Na+、NH4+、CO32-、NO3- |
| D、水电离出的c(H+)=1×10-13mol?L-1的溶液中:K+、HCO3-、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
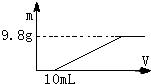 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )| A、0.05mol |
| B、0.1mol |
| C、0.2mol |
| D、0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2NA个氢分子的体积为4.48L |
| B、常温常压下,5.85g NaCl中含有0.1NA个分子 |
| C、200mL 1mol?L-1的Fe2(SO4)3溶液中Fe3+数小于0.4NA |
| D、1mol Cl2与足量NaOH溶液充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-=BaSO4↓+H2O |
| B、少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、碳酸氢根离子发生电离:HCO3-+H2O?H3O++CO32- |
| D、将1mol?L-1 NaAlO2溶液和1.5mol?L-1 HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 |  |  |  | |
| 添加试剂 | 10.0mL FeSO4溶液 | 10.0mL FeSO4溶液+2mL煤油 | 10.0mL FeSO4溶液+1.0g铁粉 | 10.0mL FeSO4溶液+ |
| 3天内的现象 | / | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知难溶性物质K2SO4?MgSO4?2CaSO4在水中存在如下平衡:
已知难溶性物质K2SO4?MgSO4?2CaSO4在水中存在如下平衡:| A、向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B、向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C、升高温度,反应速率增大,平衡向正反应方向移动 |
| D、该平衡的Ksp=c(Ca2+)?c(K+)?c(Mg2+)?c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com