
随着社会的发展,人们日益重视环境问题。下列做法或说法正确的是( )
A.提倡使用一次性发泡塑料餐具和塑料袋
B.绿色化学的核心是应用化学原理治理环境污染
C.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
D.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
科目:高中化学 来源: 题型:
已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置________。
(2)在一定条件下,由X单质与Z单质反应生成1 mol E放出的热量为46.2 kJ,写出该反应的热化学方程式:_________________________________
________________________________________________________________________;
E在催化剂存在的条件下,可用于还原汽车尾气中的________,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效化肥,但长期施用会使土壤酸化,有关的离子方程式为________________________________________
________________________________________________________________________;
由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为_______________________________________________
________________________________________________________________________。
(4)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式_________________________________________________________
____________________________________________________________________。该反应
中被氧化的E与参与反应的E的质量之比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
克隆羊的关键技术之一是找到一些特殊的酶,这些酶能激活普通体细胞,使之像生殖细胞一样发育成个体。有关酶的叙述错误的是( )
A.大多数酶是具有催化作用的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温或重金属盐能降低酶的活性
D.酶只有在强酸性或强碱性条件下才能发挥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20。则有关X的下列说法中正确的是( )
A.X中阳离子和阴离子个数不一定相等
B.X中一定有离子键,一定不含共价键
C.若X只含两种元素,则这两种元素可在同一周期也可在同一主族
D.X中阳离子半径一定大于阴离子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,Y、Z两种元素的质子数之和为W、X两种元素的质子数之和的3倍。由此可知:
(1)元素W为________,X为________,Y为________,Z为________。
(2)上述元素中任意三种组成的,既含有离子键又含有共价键的化合物的化学式有________(至少写三种)。
(3)四种元素两两组合,能生成共价化合物的化学式有________、________、________、________。
(4)上述四种元素可组成化合物________,其中有______键、________键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.Ag+、NO3-、Cl-、K+ B.H+、NO3-、Fe2+、Na+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢气能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH = +206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g)
ΔH = +247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g) ΔH = +169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为________________________________________________。
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2 与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式___________________________________________________。
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中 A、B 表示的物质依次是_____________________________________。
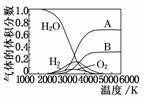
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com