

| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g?cm-3 | 难溶于水,易溶于醇、醚等 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、四氧化三铁溶于稀硝酸:Fe3O4+8H+=4H2O+Fe2++2Fe3+ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
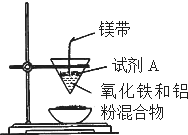 某小组进行铝热反应实验,装置如图所示.
某小组进行铝热反应实验,装置如图所示.| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| 2 | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
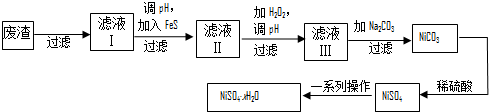
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、滴有酚酞溶液的装置②在电解过程中,b极先变红 |
| C、可以用装置③在铁上镀铜,d极为铜 |
| D、装置④中发生铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| KOH |
| 室温 |

查看答案和解析>>
科目:高中化学 来源: 题型:
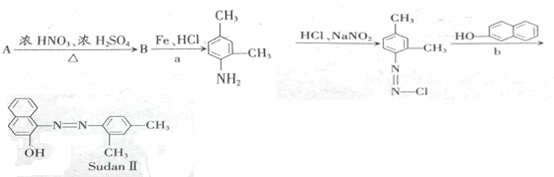
查看答案和解析>>
科目:高中化学 来源: 题型:
10 甲 |
| 浓硫酸,△ |
| 或Al2O4,△ |
8 乙 |
| Br2 |
| 溶液CCl4 |
8 丙 |
| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com