
分析 (1)△H1=-225.8kJ/mol<0,所以是放热反应;
(2)由2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol可知,消耗2mol的碳放出热量为225.8kJ;
(3)由C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol可知,生成1mol的二氧化碳放出热量为:394.4kJ;
(4)①2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol
②C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol
根据盖斯定律:由①-②得C(s)+CO2(g)═2CO(g)△H的值.
解答 解:(1)△H1=-225.8kJ/mol<0,所以是放热反应,故答案为:放热;
(2)由2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol可知,消耗2mol的碳放出热量为225.8kJ,所以消耗24gC(s)时放出热量为225.8kJ,故答案为:-225.8;
(3)由C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol可知,生成1mol的二氧化碳放出热量为:394.4kJ,故答案为:-394.4;
(4)①2C(s)+O2(g)═2CO(g)△H1=-225.8kJ/mol
②C(s)+O2(g)═CO2 (g)△H2=-394.4kJ/mol
根据盖斯定律:由①-②得C(s)+CO2(g)═2CO(g)△H=(-225.8kJ/mol)-(-394.4kJ/mol)=+168.6kJ/mol,故答案为:+168.6.
点评 本题考查反应热的计算,题目难度不大,注意盖斯定律的运用.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
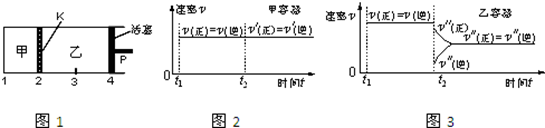
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Cu+Fe 3+ | |
| B. | 铜与稀硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
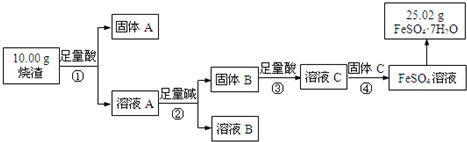
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 | |
| C. | 硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅单质即能与氢氧化钠反应又能与氢氟酸反应,所以硅是两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述实验中不能用盐酸代替硫酸 | |
| B. | 将试管充分振荡后静置,溶液颜色变为紫色 | |
| C. | 在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 | |
| D. | 若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
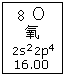
| A. | 氧元素的质量数是16 | |
| B. | 氧元素的相对原子质量是16.00 | |
| C. | 氧原子2p亚层有一个未成对电子 | |
| D. | 氧原子最外层有6个能量相同的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com