
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | NH3•H2O |
分析 都为氯化物,可根据阳离子的不同选择检验方法,可加入碱,生成沉淀的颜色、现象不同,以此解答该题.
解答 解:A.KSCN只能鉴别氯化铁,故A错误;
B.均不与氯化钡反应,不能鉴别,故B错误;
C.分别滴加NaOH溶液时,产生白色沉淀的是氯化镁;先产生沉淀,后沉淀溶解的是氯化铝;产生红褐色沉淀的是氯化铁;产生白色沉淀,后又变灰绿色,最后变成红褐色的是氯化亚铁;无现象的是氯化钠,现象不同,可鉴别,故C正确;
D.加入氨水,不能鉴别氯化铝、氯化镁,故D错误.
故选C.
点评 本题考查物质的检验和鉴别的实验方案的设计,侧重考查学生的分析能力和实验能力,题目难度不大,本题注意根据金属阳离子的性质不同选择检验试剂,注意碱的颜色和水溶性.


科目:高中化学 来源: 题型:实验题
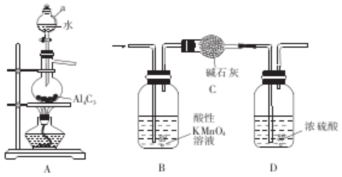
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在反应中被还原 | |
| B. | NaClO3在反应中失去电子 | |
| C. | H2SO4在反应中作氧化剂 | |
| D. | 1 mol氧化剂在反应中得到1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③⑤ | C. | ④⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.3 mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| B. | Z元素在反应③中被还原,在反应①中被氧化 | |
| C. | Z2可以置换出X2+溶液中的X | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
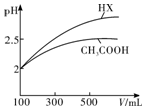
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:1 | C. | 3:13 | D. | 4:15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com