
【题目】甲苯是一种重要的化工原料,可以参与合成很多物质。下图为以甲苯为原料得到药物苯佐卡因的合成路线。
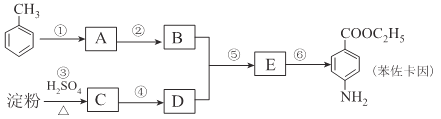
已知:i.苯环上连有甲基时,再引入其他基团主要进入甲基的邻位或对位;苯环上连有羧基时,再引入其他基团主要进入羧基的间位;
Ⅱ.![]() (有弱碱性,易被氧化)。
(有弱碱性,易被氧化)。
请回答下列问题:
(1)化合物C中官能团的结构简式为____________,检验反应③进行程度的试剂有____________。
(2)合成路线中反应类型属于取代反应的有____________个
(3)反应①的化学方程式为____________,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为____________。
(4)反应⑤的化学方程式为____________。
(5)甲苯的链状且仅含碳碳三键的同分异构体有____________种,其中满足下列条件的同分异构体的结构简式为____________。
①核磁共振氢谱只有两个吸收峰②峰面积之比为1:3
(6)化合物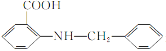 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
提示:①合成过程中无机试剂任选:②合成路线流程图示例如下:
【答案】
(1)-OH,-CHO;碘水、NaOH溶液、银氨溶液(或新制氢氧化铜)
(2)3
(3) ;2,4,6一三硝基甲苯(或三硝基甲苯)
;2,4,6一三硝基甲苯(或三硝基甲苯)
(4)
(5)10;CH3-C≡C-CH2-C≡C-CH3、
(6)
【解析】
试题分析:(1)淀粉渣硫酸作用下水解生成葡萄糖,葡萄糖中含有羟基和醛基,官能团的结构简式为-OH,-CHO;检验淀粉水解程度的,可以选择碘水具有是否水解完全,检验生成的葡萄糖,需要用氢氧化钠中和硫酸,在用银氨溶液具有,故答案为:-OH,-CHO;碘水、NaOH溶液、银氨溶液(或新制氢氧化铜);
(2)反应③是淀粉的水解反应,属于取代反应,反应④为葡萄糖制乙醇的反应,属于分解反应,根据苯环上连有甲基时,再引入其他基团主要进入甲基的邻位或对位;苯环上连有羧基时,再引入其他基团主要进入羧基的间位,反应①属于苯环的硝化反应,属于取代反应,反应②为苯环侧链的氧化反应,反应⑤是酯化反应属于取代反应,反应⑥是硝基的还原反应,合成路线中反应类型属于取代反应的有3个,故答案为:3;
(3)反应①是苯环的硝化反应,化学方程式为 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F是三硝基甲苯,故答案为:
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F是三硝基甲苯,故答案为: ;2,4,6一三硝基甲苯(或三硝基甲苯);
;2,4,6一三硝基甲苯(或三硝基甲苯);
(4)反应⑤是酯化反应,反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(5)甲苯的链状且仅含碳碳三键的同分异构体有![]() (●为三键可能存在的位置)4种,
(●为三键可能存在的位置)4种,![]() 2种,
2种,![]() 2种,
2种,![]() 1种,
1种, 1种,共11种;①核磁共振氢谱只有两个吸收峰②峰面积之比为1:3满足上述条件的同分异构体的结构简式为CH3-C≡C-CH2-C≡C-CH3、
1种,共11种;①核磁共振氢谱只有两个吸收峰②峰面积之比为1:3满足上述条件的同分异构体的结构简式为CH3-C≡C-CH2-C≡C-CH3、 ,故答案为:11;CH3-C≡C-CH2-C≡C-CH3、
,故答案为:11;CH3-C≡C-CH2-C≡C-CH3、 ;
;
(6)以甲苯为主要原料制备![]() ,可以先用甲苯发生硝化反应在邻为引入硝基,再将甲基氧化为羧基,再将硝基还原为氨基,制得邻氨基苯甲酸,再用甲苯制得
,可以先用甲苯发生硝化反应在邻为引入硝基,再将甲基氧化为羧基,再将硝基还原为氨基,制得邻氨基苯甲酸,再用甲苯制得![]() ,最后反应得到产品,流程图:
,最后反应得到产品,流程图: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号B:_________ C:_________
(2)BA2的电子式 _________ ,BA2分子中化学键属于_________ 键。
(3)D2A2的化学式 _________ ,灼烧这化合物火焰呈_________ 色。
(4)C在元素周期表中的位置是第_________周期,_______族,其原子结构示意图为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是
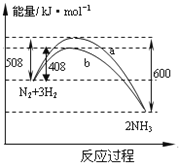
A.该反应的热化学方程式为:1/2N2(g)+3/2H2(g)![]() NH3(g) △H=-92kJ·mol-1
NH3(g) △H=-92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
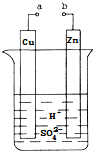
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A.Cl-、Br-、CrO42- B.CrO42-、Br、Cl- C.Br-、Cl-、CrO42- D.Br、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应中,属于放热反应的是 ,属于吸热反应的是 。①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
(3)14CO2与碳在高温条件下发生反应:14CO2+C![]() 2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,固定体积的密闭容器内,反应2HI(g)![]() H2 (g)+ I2 (g)达到平衡状态的标志是:
H2 (g)+ I2 (g)达到平衡状态的标志是:
①I2的体积分数不再变化;
②生成1 mol H2同时消耗1 molI2;
③容器内压强不再变化;
④生成2 mol HI同时消耗1molH2;
⑤气体的密度不再变化;
⑥混合气体的平均分子质量不再变化
A.①②③④⑤⑥ B.①②③⑤⑥ C.①②⑤⑥ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
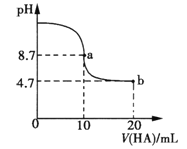
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题:
(1)单质铁属于_______晶体。黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,氧化产物为_________,若有3molFeS2参加反应,转移_______mol电子。
6SO2+Fe3O4,氧化产物为_________,若有3molFeS2参加反应,转移_______mol电子。
(2)铝的价电子排布式为_________,明矾用作净水剂,其原理为_______________(用离子方程式表示)。
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,Cu与氨水、双氧水反应的离子方程式_______________;
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL5molL-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,参加反应的铁粉的质量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com