

分析 (1)①n(CuSO4)=0.1L×2.0mol/L=0.2mol,n(H2SO4)=0.1L×1.0mol/L=0.1mol,而溶液中n(SO42-)=n(CuSO4)+n(H2SO4);
②根据稀释定律,混合前后CuSO4、H+的物质的量不变,据此计算混合溶液中c(CuSO4)、c(H+);
(2)Fe的物质的量为$\frac{28g}{56g/mol}$=0.5mol,反应生成气体为氢气,说明溶液中Cu2+完全反应,由Fe+CuSO4=Cu+FeSO4,可知0.2mol CuSO4完全反应消耗Fe为0.2mol,由Fe+H2SO4=FeSO4+H2↑,可知0.1mol H2SO4完全消耗Fe为0.1mol,故共消耗Fe为0.3mol<0.5mol,则Fe有剩余.
根据H原子守恒计算氢气体积,固体质量为生成的Cu与剩余Fe的质量之和,反应后溶液中加入氢氧化钠,恰好反应得到沉淀,最终溶质为Na2SO4,由钠离子、硫酸根守恒可知n(Na)=2n(Na2SO4)=2n(H2SO4),进而计算NaOH溶液体积.
解答 解:(1)①n(CuSO4)=0.1L×2.0mol/L=0.2mol,n(H2SO4)=0.1L×1.0mol/L=0.1mol,则混合后溶液中n(SO42-)=n(CuSO4)+n(H2SO4)=0.2mol+0.1mol=0.3mol,
故答案为:0.3mol;
②根据稀释定律,混合前后CuSO4的物质的量不变,则混合液中c(CuSO4)=$\frac{1}{2}$×2.0mol/L=1mol/L,
混合前后H+的物质的量不变,则混合溶液中c(H+)=$\frac{1}{2}$×2×1.0mol/L=1mol/L,
故答案为:1mol/L;1mol/L;
(2)Fe的物质的量为$\frac{28g}{56g/mol}$=0.5mol,反应生成气体为氢气,说明溶液中Cu2+完全反应,由Fe+CuSO4=Cu+FeSO4,可知0.2mol CuSO4完全反应消耗Fe为0.2mol,由Fe+H2SO4=FeSO4+H2↑,可知0.1mol H2SO4完全消耗Fe为0.1mol,故共消耗Fe为0.3mol<0.5mol,则Fe有剩余,
故n(H2)=n(H2SO4)=0.1mol,则V(H2)=0.1mol×22.4L/mol=4.48L,则V=4.48;
剩余Fe为0.5mol-0.3mol=0.2mol,故固体质量为0.2mol×64g/mol+0.2mol×56g/mol=24g,则m=24;
反应后溶液中加入氢氧化钠,恰好反应得到沉淀,最终溶质为Na2SO4,由钠离子、硫酸根守恒可知n(Na)=2n(Na2SO4)=2n(H2SO4)=0.2mol,则NaOH溶液体积为$\frac{0.2mol}{1mol/L}$=0.2L=200mL,则a=200,
故答案为:4.48;24;200.
点评 本题考查混合物计算、物质的量难度计算,(2)中关键是明确反应先后顺序判断Fe是否反应完全,侧重考查学生分析计算能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 某反应的焓变小于零,该反应一定能自发进行 | |
| B. | 用湿润的PH试纸测稀盐酸溶液的pH为3.52 | |
| C. | 原电池是将化学能转变为电能的装置 | |
| D. | 草木灰(K2CO3)是钾肥,硫酸铵是氮肥,两者混合施用可以提高肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都能与水反应生成对应的酸 | |
| B. | 标准状况下它们都是无色无味的气体 | |
| C. | 分子中氧元素的质量分数:NO>NO2>SO2 | |
| D. | 实验室可以利用氧化还原反应分别制备NO、NO2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 3.92L | C. | 3.36L | D. | 2.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式:-CHO | B. | 甲烷的电子式: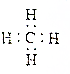 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
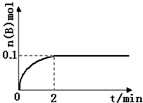 在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.
在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3>H2O>HF | |
| C. | 密度大小:Rb>K>Na>Li | |
| D. | 等物质的量浓度溶液,酸性强弱顺序:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com