
【题目】按下列要求书写反应方程式,有要求的要注明反应类型。
1、乙烯与Br2的反应: 。反应类型: 。
2、乙烯制聚乙烯 :
3、苯与液溴的反应 : 。反应类型: 。
4、乙醇与金属钠的反应:
5、乙醇的催化氧化反应:
【答案】
1、CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
2、![]() ;
;
3、![]() ;取代反应;
;取代反应;
4、2CH3CH2OH+2Na→2CH3CH2ONa+H2 ;
5、2C2H5OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
【解析】
试题分析:1、因乙烯能与溴发生加成反应:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
2、乙烯制备聚乙烯发生加聚反应,化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
3、苯与液溴在溴化铁的催化作用下生成溴苯,苯环上的一个氢原子被一个溴原子取代,其反应方程式为:![]() ;该反应为取代反应,故答案为:
;该反应为取代反应,故答案为:![]() ;取代反应;
;取代反应;
4、因乙醇能和钠发生取代反应生成乙醇钠和氢气:2CH3CH2OH+2Na→2CH3CH2ONa+H2,故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2 ;
5、乙醇发生催化氧化生成乙醛,反应为2C2H5OH+O2![]() 2CH3CHO+2H2O,故答案为:2C2H5OH+O2
2CH3CHO+2H2O,故答案为:2C2H5OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是( )
A. 该化合物仅含碳、氢两种元素
B. 该化合物中碳、氢原子个数比为1:2
C. 无法确定该化合物是否含有氧元素
D. 该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料涉及的主要反应有: 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3= +198 kJ·mol-1
H3= +198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
![]()
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。 ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
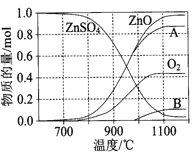
①写出700℃~980℃时发生反应的化学方程式: ,物质B的化学式是 。
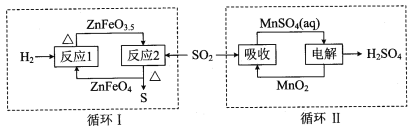
②硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式: ;循环II中电解过程阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeBr2 + 3Cl2 = 2FeCl3+2Br2 ② Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Fe + CuSO4 = FeSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
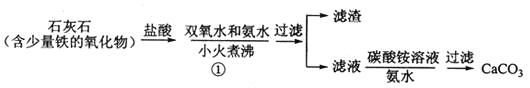
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
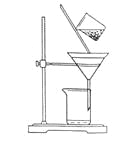
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置反映了元素的原子结构和元素的性质。下是元素周期表的一部分。
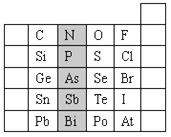
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol。下列说法正确的是( )
在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol。下列说法正确的是( )
A.容器中NH3的物质的量一定增加了0.30mol
B.容器中H2O(g)的物质的量至少为0.45mol
C.NH3的平均反应速率为0.010mol/(L·s)
D.NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2是怎么样产生的? (用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是: 。
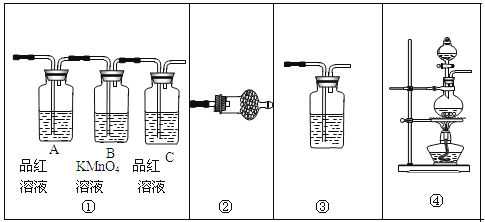
(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是______,B瓶的作用是______,C瓶的作用是______。
(4)装置②中所加的试剂名称是______,它可以验证的气体是______,简述确定装置②在整套装置中的位置的理由是___ ___。
(5)装置③中所盛溶液的名称是______,它可以用来验证的气体是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com