
| A. | 某溶液水电离的c(H+)•c(OH-)=10-24 | B. | c(H+)=10-12mol/L的溶液 | ||
| C. | 甲基橙呈黄色的溶液 | D. | 某溶液与Al粉反应产生氢气 |
分析 水溶液中都含有氢离子和氢氧根离子,溶液酸碱性取决于氢离子和氢氧根离子的浓度的相对大小,pH值>7,溶液呈碱性,据此判断.
解答 解:A.常温下,水的离子积常数K=10-14,故A错误;
B.c(H+)=10-12mol/L的溶液,c(OH-)=10-2,溶液呈碱性,pH>7,故B正确;
C.甲基橙呈黄色,溶液呈酸性,pH<7,故C错误;
D.Al既能与酸反应生成氢气,也能与碱反应生成氢气,故不一定是碱性溶液,故D错误,故选B.
点评 本题考查了溶液酸碱性的判断,注意氢离子和氢氧根离子的浓度的相对大小是绝对判据,如果用溶液中氢离子或者氢氧根离子浓度大小或者pH值的大小判断,必须说明温度,否则无法确定.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③⑤⑥⑦⑧ | C. | ④⑤⑥⑦⑧ | D. | ①②③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
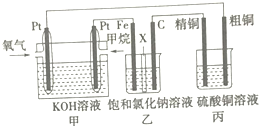 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间内消耗a molA,同时生成2a mol C | |
| C. | A的浓度不再变化 | |
| D. | 混合气体总物质的量为2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别Na[Al(OH)4]溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
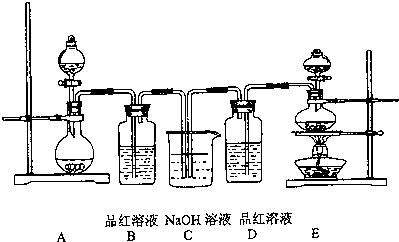
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com