
 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:分析 (1)先配平化学方程式,结合化学方程式定量关系计算得到;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3.利用的是溶解度不同析出晶体;
(3)①依据Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,计算得到银离子浓度,结合Ksp(AgCl)=1.8×10-10,计算得到氯离子浓度;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.
n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g,
纯度=$\frac{KCl{O}_{4}质量}{样品质量}$×100%.
解答 解:(1)电解时,产生质量为2.13g NaClO3,物质的量=$\frac{2.13g}{106.5g/mol}$=0.02mol
NaCl+3H2O=NaClO3+3H2↑,
1 3
0.02mol 0.06mol
同时得到H2的物质的量为0.06mol,体积=0.06mol×22.4L/mol=1.344L,
故答案为:1.344;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出,
故答案为:低温时,KClO3溶解度小,从溶液中结晶析出;
(3)①若c(CrO42-)=1.1×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+)c(CrO4 2-)=1.1×10-12,c(Ag+)=10-4mol/L,
Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,c(Cl-)=1.8×10-6 mool/L,
故答案为:1.8×10-6;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.
n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g
KClO4样品的纯度=$\frac{5.54g}{5.689g}$×100%=97.3%,
故答案为:97.3%.
点评 本题考查了物质的组成和含量的测定,主要是滴定实验的过程和计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 当X是盐酸时,则F是稀硝酸24 | |
| B. | 当X是氢氧化钠时,则F是稀硝酸y | |
| C. | 当X是氢氧化钠时,B跟Cl2反应可能有白烟现象e | |
| D. | 当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
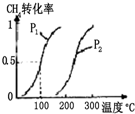 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
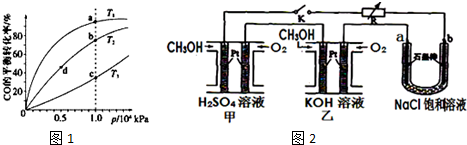
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com