
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
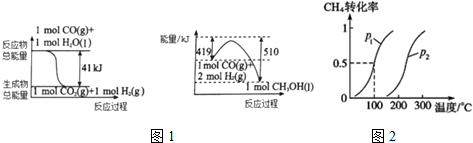
分析 (1)根据图1中能量变化写出反应的热化学方程式,然后根据盖斯定律写出由二氧化碳和氢气制备甲醇的热化学方程式;
(2)T1℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量;
①该反应正方向为体积增大的方向,增大压强,甲烷的转化率减小;
②可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答;
③根据5min和10min时各物质浓度的变化来确定改变条件,反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增大了氢气的浓度.
解答 解:(1)图1中的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,
依据盖斯定律②-①得:二氧化碳和氢气制备甲醇的热化学方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)①该反应正方向为体积增大的方向,相同温度下,增大压强,甲烷的转化率减小,由图可知,相同温度下,P2 的转化率比P1小,说明P2<P1;
故答案为:<;该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;
②a.生成CH3OH的速率与消耗CO的速率均为正反应速率,不能判断平衡状态,故错误;
b.混合气体的体积始终保持不变,质量守恒,所以混合气体的密度始终不变,所以不能判断平衡状态,故错误;
c.该反应为气体的物质的量减少的反应,混合气体的总物质的量不变,说明反应达到平衡状态,故正确;
d.CH3OH、CO、H2的浓度都不再发生变化,说明反应达到平衡状态,故正确;
故答案为:cd;
③反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增大了氢气的浓度,氢气浓度增大了0.2mol/L-0.12mol/L+0.02mol/L=0.1mol/L,则加入的氢气的物质的量为10L×0.1mol/L=1mol,
故答案为:加了1 mol氢气.
点评 本题考查了化学平衡移动原理、盖斯定律等知识点,注意把握化学平衡移动的分析和判断,要结合浓度该变量来确定改变条件,难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Z元素的含氧酸一定是强酸 | |
| B. | 原子半径:X>Z | |
| C. | 气态氢化物热稳定性:W>X | |
| D. | W、X与H形成化合物的水溶液可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质①是最活泼的非金属单质 | |
| B. | 单质②能使品红溶液褪色 | |
| C. | 保存少量的单质③时加少量水进行水封 | |
| D. | 单质④的氢化物在卤素氢化物中沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
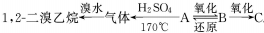 ,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;
,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
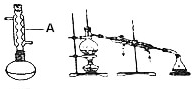 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: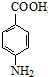 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$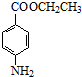 +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com