
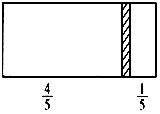
 一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )| A. | 右边与左边分子数之比为4:1 | |
| B. | 右侧CO的质量为5.6 g | |
| C. | 右侧气体密度是相同条件下氢气密度的14倍 | |
| D. | 若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO |
分析 左右两侧气体温度、压强相同,相同条件下,体积之比等于物质的量之比,左右体积之比为4:1,则左右气体物质的量之比为4:1,所以右侧气体物质的量=$\frac{1mol}{4}$=0.25mol,
A.气体的物质的量之比等于其分子数之比;
B.根据m=nM计算CO质量;
C.相同条件下气体密度之比等于其摩尔质量之比;
D.隔板处于容器正中间时,左右两侧气体的物质的量相等.
解答 解:左右两侧气体温度、压强相同,相同条件下,体积之比等于物质的量之比,左右体积之比为4:1,则左右气体物质的量之比为4:1,所以右侧气体物质的量=$\frac{1mol}{4}$=0.25mol,
A.气体分子数与物质的量成正比,则右边与左边分子数之比为1:4,故A错误;
B.右侧CO的质量为:28g/mol×0.25mol=7g,故B错误;
C.相同条件下密度之比与摩尔质量成正比,则右侧气体密度是相同条件下氢气密度的$\frac{28}{2}$=14倍,故C正确;
D.相同条件下气体体积与物质的量成正比,隔板处于容器正中间时,左右两侧气体的物质的量相等,则需要充入CO的物质的量为:1mol-0.25mol=0.75mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗定律的应用,题目难度不大,明确阿伏伽德罗定律及推理的内容为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
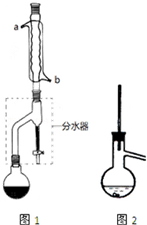 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )
在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )| A. | 正反应放热,L是气体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L不是气体 | D. | 正反应吸热,L不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 常温常压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度反比 | |
| D. | 同温同体积时,两种气体的物质的量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com