
已知:P4(s、白磷)+5O2(g)═P4O10(s);△H=﹣2983.2kJ/mol4P(s、红磷)+5O2(g)═P4O10(s);△H=﹣2954kJ/mol
那么,1mol红磷转变成相应物质的量白磷时,应是()
A. 吸收29.2kJ热量 B. 放出29.2kJ热量
C. 放出7.3kJ热量 D. 吸收7.3kJ热量
考点: 有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式即可.
解答: 解:红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),
可以看成是下列两个反应方程式的和:P4O10(s)=P4(s、白磷)+5O2(g);△H=2983.2kJ•mol﹣1;4P(s、红磷)+5O2(g)=P4O10(s);△H=﹣738.5×4kJ•mol﹣1=﹣2954kJ•mol﹣1;
根据盖斯定律,红磷转化为白磷4P(s、红磷)=P4(s、白磷)的△H=2983.2kJ/mol﹣2954kJ•mol﹣1=29.2KJ/mol,
即4P(s、红磷)=P4(s、白磷)△H=+29.2KJ/mol,红磷转化为白磷的热化学方程式可知过程是一个吸热反应,
故选A.
点评: 本题考查学生利用盖斯定律来计算化学反应的焓变这一知识,可以根据所学知识进行回答,难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是
和 。(填化学式)
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕色沉淀,向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为 。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
②现需要200mL 0.1mol/L的A溶液,需用托盘天平称取A固体的质量为 g,配制溶液时,所需要的玻璃仪器除玻璃棒、烧杯外,还需要 。
③利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,没有颜色变化的是( )
|
| A. | 淀粉溶液中加入稀硫酸 |
|
| B. | 鸡蛋清中加入浓硝酸 |
|
| C. | 淀粉溶液中加入碘酒 |
|
| D. | 葡萄糖溶液与新制氢氧化铜浊液混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B⇌3C+4D中,表示该反应速率最快的是()
A. υ(A)=0.5mol•L﹣1•S﹣1 B. υ(B)=0.3 mol•L﹣1•S﹣1
C. υ(C)=0.8mol•L﹣1•S﹣1 D. υ(D)=1 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,25ml 0.10mol/L醋酸溶液中存在下列电离平衡:CH3COOH(aq)⇌CH3COO﹣(aq)+H+(aq)
若分别作如下改变,对上述电离平衡有何影响?
实验 平衡移动的方向 c(H+)的变化
1.加入少量冰醋酸(无水醋酸).
2.加入一定量蒸馏水.
3.加入少量0.10mol/L盐酸.
4.加入20ml0.10mol/LNaCl溶液.
5.加入10ml0.10mol/L CH3COONa溶液.
6.加入一定量的稀氨水.
7.加热溶液.
(平衡移动的方向填“不移动”、“正反应方向”或“逆反应方向”; c(H+)的变化填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
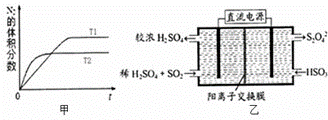
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一.
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图甲所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H 0(填“>”或“<”).
②在T3温度下,向2L密闭容器中充入10mol N2与5mol O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)= .该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为 .
(2)利用如图乙所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2.
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32﹣生成.该反应中氧化剂与还原剂的物质的量之比为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol•L﹣1的醋酸与b mol•L﹣1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)═c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka= (用含a和b的代数式表示).
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42﹣互为等电子体的分子 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com