
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
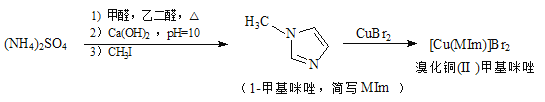
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与NH4+互为等电子体的阴离子为_______。
(3)SO42-中心原子的杂化方式为_________。
(4)Mlm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如下图所示。
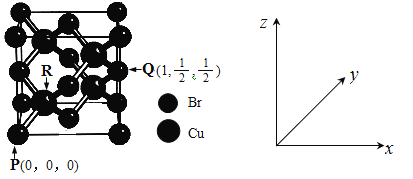
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。

(6)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为____,晶体的空间利用率为__________。(列式计算)
【答案】 IB [Ar]3d9 BH4- sp3杂化 6:1 (![]() ) 12
) 12 ![]() (或74.76%)
(或74.76%)
【解析】(1)铜核电荷数为29,其电子排布式为[Ar]3d104s1,则铜元素位于周期表中第四周期第IB族,基态Cu2+的电子排布式IB;
(2)NH4+的原子数目为5,价电子总数为8,则与NH4+互为等电子体的阴离子为BH4-;
(3)SO42-中,价层电子对数=σ键个数+![]() (a-xb)=4+
(a-xb)=4+![]() (6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化;
(6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化;
(4)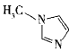 中双键数2,即π数目为2,单键数为12,即σ键数目为12,Mlm中含σ键与π数目之比为6:1;
中双键数2,即π数目为2,单键数为12,即σ键数目为12,Mlm中含σ键与π数目之比为6:1;
(5)图中P点坐标参数(0、0、0)和Q点原子坐标参数(1、![]() 、
、![]() ),可知晶胞边长设为1,PR点为晶胞对角线的
),可知晶胞边长设为1,PR点为晶胞对角线的![]() ,则可确定R点的原子坐标参数为(
,则可确定R点的原子坐标参数为(![]() ) ;
) ;
(6)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为![]() =12;晶胞中Cu原子数目为8×
=12;晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,设Cu原子半径为d,则Cu原子总体积为4×
=4,设Cu原子半径为d,则Cu原子总体积为4×![]() πa3,晶胞棱长=4a×
πa3,晶胞棱长=4a×![]() =2
=2![]() a,晶胞体积为(2
a,晶胞体积为(2![]() a)3,晶胞空间利用率=(4×
a)3,晶胞空间利用率=(4×![]() πa3)÷((2
πa3)÷((2![]() a)3)×100%=
a)3)×100%= ![]() =74.76%。
=74.76%。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应:
X(g)+ Y(g)![]() 2Z(g),在反应过程中,X的物质的量与时间的关系如下表所示:
2Z(g),在反应过程中,X的物质的量与时间的关系如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | …… | 16 | 18 |
n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | …… | …… | 1.000 | 1.000 |
下列说法不正确的是( )
A. 4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L·min)
B. 此温度下该反应的平衡常数K=1.44
C. 达平衡后,升高温度,![]() 减小,则正反应
减小,则正反应![]()
D. 若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应的进行一定需要加热
B. 该反应的ΔH=-(E1-E2) kJ/mol
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 断裂1 mol A—A键和2 mol B—B键放出E1 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有CuO、Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有
A.4个 B.5个 C.6个 D.7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )

A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时1体积某气态烃和4体积O2混合,完全燃烧后恢复到原来的温度和压强时,体积不变,该分子式中所含的碳原子数不可能是
A. 1 B. 2 C. 3 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。

①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的离子组是
A.Mg2+、Na+、Cl-、CO32- B.Ba2+、K+、OH-、NO3-
C.H+、Fe3+、NH4+、SO42- D.Na+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代药学著作《本草经集注》共七卷,其中对“消石”的注解如下:“… 如握雪不冰。强烧之,紫青烟起,仍成灰…”。这里的“消石”是指
A. 氢氧化钙 B. 硝酸钾 C. 高锰酸钾 D. 硝酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com