
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
分析 设Na+、Fe3+、Cl-的物质的量分别为1mol、2mol、3mol,根据溶液中电荷守恒有3n(Fe3+)+n(Na+)=n(Cl-)+2n(SO42-),据此计算SO42-的物质的量,离子数目之比等于二物质的量之比.
解答 解:设Na+、Fe3+、Cl-的物质的量分别为1mol、2mol、3mol,
根据电荷守恒可得:3n(Fe3+)+n(Na+)=n(Cl-)+2n(SO42-),
即:1mol+2×3mol=3mol+2n(SO42-),
解得:n(SO42-)=2mol,
物质的量之比等于离子数目之比,
则溶液中Fe3+和SO42-离子的个数比为2mol:2mol=1:1,
故选A.
点评 本题考查物质的量浓度的有关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,明确电荷守恒的含义为解答关键,注意掌握守恒思想在化学计算中的应用.


科目:高中化学 来源: 题型:选择题
| A. | [N(CH3)4]+中只含共价键 | B. | 该反应中,SO2作氧化剂 | ||
| C. | SO2漂白品红是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
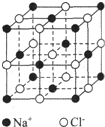
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
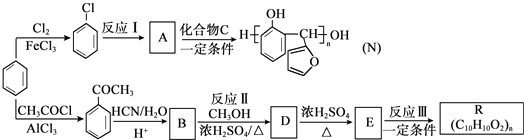

 .
. 生成
生成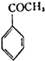 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂.
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
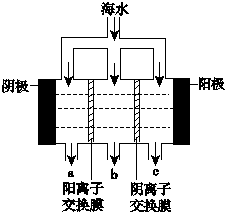 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na:两个钠元素 | |
| B. | 2OH-:两个氢氧根离子 | |
| C. | $\stackrel{+2}{M}$g:镁元素的化合价为+2价 | |
| D. | NO2:一个二氧化氮分子含有两个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
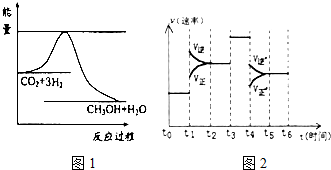 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com