
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
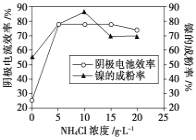
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
【答案】增大盐酸的浓度(或将镍废料研成粉末等) 5.0~7.1 NaCl 2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O 10 g/L 2H++2e-=H2 ↑(或2NH4++2H2O+2e-=2NH3·H2O+H2↑) 2[NiC2O4·2H2O]![]() Ni2O3+3CO↑+CO2↑+4H2O
Ni2O3+3CO↑+CO2↑+4H2O
【解析】
酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢可以将Fe2+氧化为Fe3+,加入Na2CO3溶液调节溶液的pH,使Fe3+、Al3+全部形成沉淀,向过滤后的滤液中再加入碳酸钠可以形成NiCO3沉淀,滤液A中含有NaCl等物质,将NiCO3溶于盐酸,得NiCl2溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3,据此分析解答。
(1)用盐酸溶解镍金属废料时,为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌,还可以将镍废料研成粉末增大接触面积,还可以通过增大盐酸的浓度的方法;
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,先加入H2O2溶液,可以将Fe2+氧化为Fe3+,然后加Na2CO3溶液,控制溶液pH,使杂质Fe3+、Al3+形成Fe(OH)3、Al(OH)3沉淀,要求沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀,根据离子沉淀的pH数值可知:溶液的pH值控制在4.7~7.1;
(3)前面用盐酸溶解镍金属废料,其中含有HCl,向溶液中加入了Na2CO3,二者会发生反应产生NaCl,加入Na2CO3溶液调整溶液的pH,形成的Fe(OH)3、Al(OH)3沉淀进入滤渣,得到的滤液中再加入Na2CO3溶液,调整溶液的pH至>9.2,形成的主要是Ni(OH)2沉淀,还含有少量的NiCO3沉淀;此时的滤液A中主要含有氯化钠、Na2CO3,可回收利用,
(4)沉淀中含有Ni(OH)2、NiCO3,用HCl溶解,Ni(OH)2、NiCO3转化为Ni2+,向溶液中加入NaClO、NaOH,在碱性条件下,NiCl2、NaClO发生氧化还原反应,Cl元素由+1价降低到-1价,反应生成NaCl,而Ni元素则由+2价升高到+3价,生成Ni2O3,根据电子守恒、电荷守恒及原子守恒,可得反应离子方程式为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O;
(5)①结合图示,阴极电流效率及镍的成粉率越高越好,根据图2可知,NH4Cl的浓度为10g/L时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10g/L;
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,在阴极上溶液中的H+放电,产生氢气,所以相应的电极反应式:2H++2e-=H2 ↑,也可写为:2NH4++2H2O+2e-=2NH3·H2O+H2↑;
(6)草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体,根据元素守恒可知混合气体为CO和CO2的混合气体,则反应为:2[NiC2O4·2H2O]![]() Ni2O3+3CO↑+CO2↑+4H2O。
Ni2O3+3CO↑+CO2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】已知NaCN溶液中CN-水解常数![]() 是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。
是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。

下列说法不正确的是
A. 其它条件不变,降低温度,可使b点变到a点
B. 相同温度时,c点对应溶液中的pH大于a点
C. 由图可知,25 ℃时,Kh(CN-)≈10-4.7
D. 向1 L lgc0=0的NaCN溶液中通入0.5 mol HCl气体,所得溶液中c(CN-)<c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答:甲池是________________装置,B(石墨)电极的名称是_____________________。
(2)写出下列电极反应式:通入CH3OH的电极的电极反应式是___________________________,A(Fe)电极的电极反应式为___________________________。
(3)乙池中反应的化学方程式为___________________________。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗标准状况下的氧气___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-221 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式为: _______________。
(2)工业上可以在恒容密闭容器中采用下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K=______。由上表数据判断,该反应的△H_______ 0(填“>”、“=”或“<”)。升高温度,正反应速率________填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为_______,此时的温度为_______。
③欲提高CO的转化率,可采取的措施是______ 。(填序号)
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:CH3COOH ![]() CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
(1)加入少量冰醋酸,平衡将_______________________,溶液中c(H+)将________________;
(2)加入一定量蒸馏水,平衡将__________________,溶液中c(H+)将__________;
(3)加入少量0.10mol/L盐酸,平衡将________________,溶液中c(H+)将_________________;
(4)加入20 mL 0.10mol/L的NaOH溶液,平衡将__________________,溶液中c(H+)将__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物已省略)。
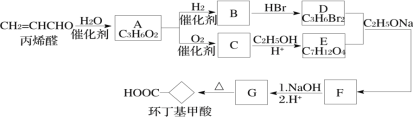
已知:
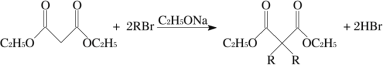
(1)
(2)![]()
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________。
(2)化合物C的结构简式是________________________。
(3)下列说法中正确的是___________(填字母代号)。
A.丙烯醛可以发生银镜反应 B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4 D.1mol化合物B与足量金属钠反应能生成1mol氢气
(4)写出D+E→F的化学方程式:__________________________________________。
(5)符合下列条件的G的同分异构体有____________种,写出其中在1H-NMR谱上显示两组峰且面积比为3∶1的结构简式:______________________。
①能使Br2/CCl4溶液褪色;②1mol G与1mol Na2CO3反应可以生成1mol CO2
(6)以1,3-丁二烯和化合物E为原料可制备![]() ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气可以制备大量的化工原料。请回答下列问题:
(1)由天然气制备合成气(CO和H2),进而可合成H2C2O4。
①欲加快H2C2O4溶液使5mL0.01mol/L酸性KMnO4溶液褪色,可采取的措施有__________、_______________(写两点)。
②下列可以证明H2C2O4是弱酸的是___________。
A.H2C2O4可以分解为CO、CO2和H2O
B.常温下,0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL
D.常温下,0.05mol/L的H2C2O4溶液pH≈4
(2)已知:①CO(g)+H2(g)![]() C(s)+H2O(g) △H1=-130kJ/mol
C(s)+H2O(g) △H1=-130kJ/mol
②CH4(g)![]() C(s)+2H2(g) △H2=+76kJ/mol
C(s)+2H2(g) △H2=+76kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H20(g) △H3=+41kJ/mol
CO(g)+H20(g) △H3=+41kJ/mol
则CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=________。
2H2(g)+2CO(g) △H=________。
(3)向2L容器中通入3molCO2、3molCH4,在不同温度下,以镍合金为催化剂,发生反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。

①高温下该反应能自发进行的原因是______________,930K时的平衡常数K=___________(保留两位小数)。
②请解释图中曲线随温度变化的原因______________。
③在700~1100K内,同温度下平衡转化率:CO2________CH4(填“大于”、“ 小于”或“等于”),结合(2)提供的反应分析,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为________mL。
![]()
(4)滴定。当______________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
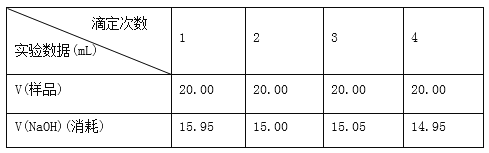
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号)。
a.pH b.沸点 c.电离常数 d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法正确的是

A. 曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH变化
C. 曲线图③可以表示相同pH的CH3COOH和HCl溶液分别加水稀释时溶液的pH随溶液体积变化的曲线
D. 曲线图④可以表示所有的固体物质溶解度随温度的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com