
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: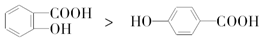 |
分析 A、原子化热是用来衡量金属键强弱的物理量,指将1摩尔金属转变成气态原子所需的最小能量;金属原子化热数值小时,其熔点低,质地软,反之则熔点高,硬度小;
B、离子半径越小,所带电荷数越大,晶格能越大;
C、信息中的共价键都是与氢原子形成的,另一种元素的非金属性越强,共价键的极性越强;
D、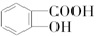 形成分子内氢键,
形成分子内氢键,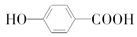 分子间氢键.
分子间氢键.
解答 解:A、根据金属镁、铝和钠的熔点可知,金属的原子化热最大的为铝,其次为镁,最小的为钠,正确关系为:Al>Mg>Na,故A正确;
B、离子半径越小,所带电荷数越大,晶格能越大,离子半径Br->Cl->O2-,离子半径越小,所带电荷数越大,晶格能越大,所以NaBr<NaCl<MgO,故B正确;
C、非金属性强到弱的是N<O<F,与氢元素形成共价键时,极性由小到大分别是N-H<H-O<H-F,故C正确;
D、 形成分子内氢键,熔沸点减小,
形成分子内氢键,熔沸点减小, 分子间氢键,熔沸点升高,所以熔点:
分子间氢键,熔沸点升高,所以熔点: >
> ,故D错误;
,故D错误;
故选D.
点评 本题考查较为综合,涉及晶体的类型以及性质的判断,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解熔融Al2O3制备金属铝 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g 由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L H2O中含有的分子的数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-所含质子数为10NA | |
| B. | 常温常压下,28克CO和N2的混合气体所含原子数为2NA | |
| C. | 4g氢气中含有的原子数为2NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com