
回答下列问题:
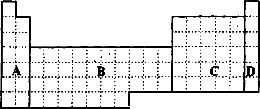
(1)在上面元素周期表中全部是金属元素的区域为________(填写字母),6号到12号元素的单质可以导电的元素有________种.
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素的元素名称是________.
(3)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的________族.
(4)现有甲、乙、丙三种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等,丙元素为第三周期元素且最高正价与最低负价的绝对值之差为6.用元素符号将甲、乙、丙三元素填写在上面元素周期表中对应的位置.并用离子符号排出三种元素简单离子的半径由大到小的顺序________.
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| cVM |
| 1000w |
| cVM |
| 10w |
| cVM |
| 1000w |
| cVM |
| 10w |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2/Cu |
| △ |
| O2 |
| △ |
| H2O/NaOH |
| △ |

| 催化剂 |
| 催化剂 |
| 浓硫酸 |
| △ |
 +2H2O
+2H2O| 浓硫酸 |
| △ |
 +2H2O
+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com