
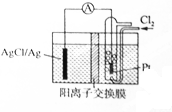
 某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 放电后交换膜溶液酸性增强 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02mol离子 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,负极反应式为Ag-e-+Cl-=AgCl,正极反应式为Cl2+2e-═2Cl-,以此解答该题.
解答 解:A.正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B.放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;
C.负极反应式为Cl-+Ag-e-=AgCl↓,正极反应式为Cl2+2e-═2Cl-,氢离子会通过阳离子交换膜移至右侧,所以放电时左边盐酸浓度降低、右边升高,右侧溶液酸性增强,故C正确;
D.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确.
故选:CD.
点评 本题考查了原电池原理的应用及沉淀反应,为高频考点,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | |
| Y | Z |
 ,U2X的电子式
,U2X的电子式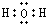
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
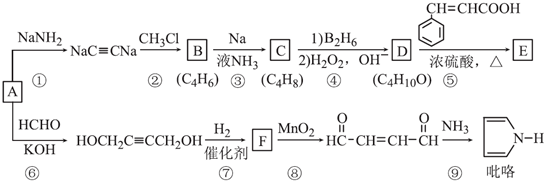
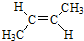 .
.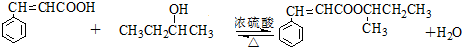 .
.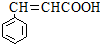 )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.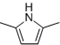 )的合成路线
)的合成路线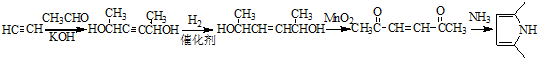 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
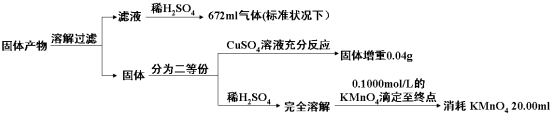
| 固体产物中的成分 | K2AB3 | … | ||
| 物质的量之比 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
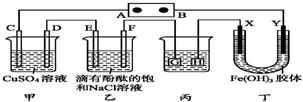 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某气体燃烧,在火焰的上方罩一个冷而干燥的烧杯,烧杯内壁有水珠生成,再将烧杯立即倒转并加入澄清石灰水溶液震荡,石灰水变浑浊,则该气体一定是烃 | |
| B. | 除去乙酸乙酯中少量的乙酸,用饱和的碳酸钠溶液洗涤,然后分液、干燥、蒸馏 | |
| C. | 1ml 1%的NaOH溶液中加入2ml 2%的CuSO4溶液,振荡后再加入0.5ml淀粉的水解液,加热后未出现砖红色沉淀,说明淀粉尚未水解 | |
| D. | 乙酸和乙醇的酯化反应实验中,向试管中加入试剂的顺序是:浓硫酸、乙醇、冰醋酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com