
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂,在单位时间内提高合成氨产率 | |
| B. | 对于2HI(g)?H2(g)+2CO(g),达平衡后.缩小容器体积可使体系颇色变深 | |
| C. | 对于2CaO2(s)?2CaO(s)+O2(g),达平衡后增大压强,再次平衡后O2的浓度保持不变 | |
| D. | 溴水中有下列平衡:Br(aq)+H2O(l)?HBr(aq)+HBrO(aq)当加入硝酸银溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,60g甲醛、乙酸与葡萄糖混合物充分燃烧消耗氧气分子数为3NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2气体不能支持任何物质的燃烧 | |
| B. | 铝合金的硬度、熔点比组成合金各成分金属的大 | |
| C. | 将一小块钠放入足量AlCl3溶液中,最终有沉淀生成的 | |
| D. | 常温下,金属镁、铝在空气中都能与氧气反应,所以它们在空气中不能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.2mol•L-1 醋酸 | B. | 0.1L 0.1mol•L-1 H2SO4溶液 | ||
| C. | 0.5L 0.1mol•L-1 盐酸 | D. | 2L 0.1mol•L-1 H2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
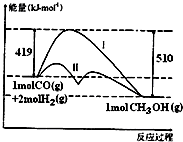 对于反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
对于反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91kJ/mol | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH时为△H1,则△H1>△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol/L CH3COONa溶液中,CH3COO-个数小于0.1NA | |
| B. | K、Zn分别与稀硫酸反应所得溶液均呈中性 | |
| C. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓氨水中加入生石灰可以制取少量的NH3 | |
| B. | 用水可以一次性鉴别溴苯、苯、乙酸三种物质 | |
| C. | 除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl | |
| D. | 实验室制备乙酸乙酯时,将溶液混合后需用大火迅速加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
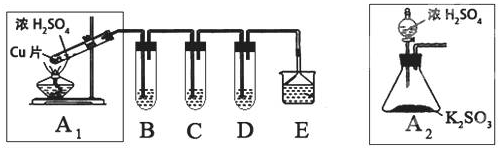
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡. | |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com