
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
分析 X、Y、Z、W都是短周期主族元素,其中X原子最外层电子数是内层电子总数的3倍,最外层电子数不能超过8个,所以X内层为K层,所以X是O元素;
X、Z同主族且都是短周期元素,所以Z是S元素;
Y、Z同周期,W与X、Y既不同主族也不同周期,则W是H元素;
X、Y、Z三种原子的最外层电子数之和为19,则Y元素最外层电子数是7,且Y、Z同一周期,所以Y是Cl元素;
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.不能根据氢化物水溶液酸性强弱判断非金属性强弱.
解答 解:X、Y、Z、W都是短周期主族元素,其中X原子最外层电子数是内层电子总数的3倍,最外层电子数不能超过8个,所以X内层为K层,所以X是O元素;
X、Z同主族且都是短周期元素,所以Z是S元素;
Y、Z同周期,W与X、Y既不同主族也不同周期,则W是H元素;
X、Y、Z三种原子的最外层电子数之和为19,则Y元素最外层电子数是7,且Y、Z同一周期,所以Y是Cl元素;
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Y>Z,所以Z元素的最高价氧化物对应的水化物酸性弱于Y元素的最高价氧化物对应的水化物,故A错误;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,
Cl-核外有3个电子层、S2-核外有3个电子层、O2-核外有两个电子层,且原子序数Y>Z,所以X、Y、Z形成的简单离子的半径大小:Zm->Yn->Xm-,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Y>Z,所以元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY,故C正确;
D.若HnY溶液的酸性比HmZ溶液的酸性强,但非金属性Y>Z,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,明确原子结构、元素周期表结构及元素周期律是解本题关键,易错选项是D,题目难度不大.


科目:高中化学 来源: 题型:解答题
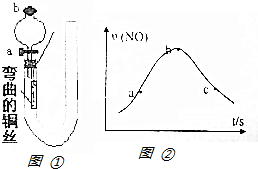 如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:
如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 3:4:3 | C. | 6:3:2 | D. | 4:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ①②⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应 | 反应物 | 氧化产物和还原产物 |
| 反应① | Cl2、FeI2 | FeCl3、FeCl2、I2 |
| 反应② | MnO4-、Cl- | Cl2、Mn2+ |
| A. | 反应①中Cl2与 FeI2的物质的量之比为2:1 | |
| B. | 反应①中发生的离子方程式可能为:2Cl2+2Fe2++2I-→I2+2Fe3++4Cl- | |
| C. | 反应②中每生成1molCl2,电子转移数目为10mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷是烃类物质中氢的质量分数最高的化合物 | |
| C. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 | |
| D. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com