
分析 ①根据烷烃的命名原则写出该有机物的结构简式;
②苯的同系物的命名:“苯的同系物命名是以苯作母体”,我们再结合烷烃命名的“近、简”原则,不难发现,当苯环上连有多个不同的烷基时,烷基名称的排列应从简单到复杂,环上编号从简单取代基开始;
③含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
④苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子;
⑤先利用减链法书写同分异构体,然后根据一氯取代物的种类等于氢原子的种类写出结构简式.
解答 解:①2,6-二甲基-4-乙基辛烷,主链为辛烷,在2、6号C各含有1个甲基,在4号C含有1个乙基,该有机物结构简式为: ,
,
故答案为: ;
;
②1,3,5-三甲苯中苯环连接3个甲基且均处于间位位置,其结构简式为 ,
,
故答案为: ;
;
③依据系统命名方法,结合名称写出结构简式,2-甲基-1-戊烯的结构简式是:CH2=C(CH3)CH2CH2CH3,
故答案为:CH2=C(CH3)CH2CH2CH3;
④苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子,则2个碳原子不可能是形成1个乙基,只能是2个甲基,且处于对角位置,其结构简式为 ;
;
故答案为: ;
;
⑤所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;
拿下1个碳原子作为支链: ;
;
拿下2个碳原子作为支链: ;
;
其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,即为 ,即C(CH3)4,
,即C(CH3)4,
故答案为:C(CH3)4.
点评 本题考查有机物的命名、有机物结构等,难度中等,注意掌握有机物的命名原则,注意书写规范.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 | |
| B. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量小于Q kJ | |
| C. | 增大压强或升高温度,该反应过程都能放出更多的热量 | |
| D. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量等于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
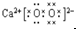 :和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
:和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3热稳定性强 | |
| B. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| C. | 相同温度下,Na2CO3的溶解度小于NaHCO3 | |
| D. | 物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3溶液的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
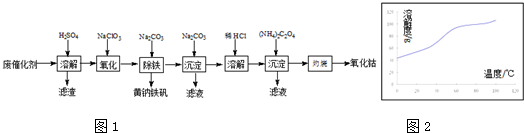
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
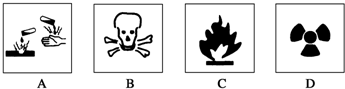
| A. | 浓硫酸----A图标 | B. | 酒精----B图标 | ||
| C. | 汽油----C图标 | D. | 放射性物品----D图标 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com