
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
|
| A. | [Al (OH)4]﹣ | B. | Cu2+ | C. | Al3+ | D. | Mg2+ |
考点:
镁的化学性质;铝的化学性质;铜金属及其重要化合物的主要性质.
专题:
元素及其化合物.
分析:
在金属活动顺序表中,排在氢前面的金属能和非强氧化性的酸反应生成氢气,金属镁和铝能溶于盐酸,铜和盐酸不反应,过滤后向滤液中加入过量烧碱溶液,镁离子能和烧碱反应转化为氢氧化镁沉淀,铝离子和过量的烧碱反应生成偏铝酸盐,据此分析解答.
解答:
解:在金属活动顺序表中,排在氢前面的金属能和非强氧化性的酸反应生成氢气,镁、铝、铜三种金属粉末混合物,加入过量盐酸,金属镁和铝能溶于盐酸,发生的离子反应有:Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+,过滤,滤液为氯化镁、氯化铝、盐酸,滤渣为铜,过滤后向滤液中加入过量烧碱溶液,过量的氢离子和氢氧根离子结合生成水,镁离子成为氢氧化镁沉淀,铝离子变成偏铝酸根离子,发生的离子反应有:H++OH﹣=H2O、Mg2++2OH﹣=Mg(OH)2↓、Al3++4OH﹣=[Al (OH)4]﹣,所以再过滤,滤液中存在的离子有[Al (OH)4]﹣,
故选A.
点评:
本题以元素的存在方式为载体考查了金属镁铝铜的性质,明确发生的反应是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数,下列说法中正确的是( )
|
| A. | 7.8g过氧化钠固体中含阴离子个数为0.2NA |
|
| B. | 34g氨气中含N﹣H的数目为6NA |
|
| C. | 标准状况下,22.4L乙炔中含π键数为2NA |
|
| D. | 1molNaHSO4晶体中阳离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年4月22日是第43个“世界地球日”,其主题为“绿色梦想,低碳行动”.下列做法符合这一主题的是( )
①开发太阳能、风能和氢能等能源;
②大量开采地下水,以满足生产、生活的需求;
③在含硫的煤中加入适量生石灰;
④利用苯、甲苯等有机物代替水作溶剂;
⑤利用可降解的“玉米塑料”生产一次性饭盒.
|
| A. | ①③⑤ | B. | ①②③ | C. | ②④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学﹣﹣选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
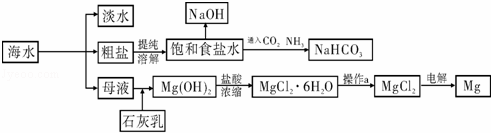
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ↑ ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 . .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不是按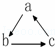 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素符号:① ;⑥ .
(2)画出⑤原子的结构示意图: .
③和⑧元素形成的化合物中含 键.(写化学键类型)
(3)在①﹣﹣⑨的元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 .(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是
(5)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),用一化学反应方程式表达这一事实 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中物质的分类组合正确的是( )
| A | B | C | D | |
| 强电解质 | Al2(SO4)3 | BaSO4 | HF | KClO3 |
| 弱电解质 | H3PO4 | H2O | CaCO3 | Al(OH)3 |
| 非电解质 | CO2 | NH3•H2O | NH3 | HI |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容的密闭容器中,对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是( )
|
| A. | 增大O2的浓度,SO3的化学反应速率减慢 |
|
| B. | 1molSO2与过量的O2反应,一定生成1molSO3 |
|
| C. | 起始投入2molSO2、1molO2与起始投入2molSO3,达到平衡状态时,SO3的体积分数相等 |
|
| D. | 往平衡体系中充入一定量的N2,使体系的压强增大,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com