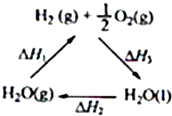
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g)?B(g)+C(g)△H=+QkJ?mol
-1(1)欲提高A的平衡转化率,可采取的措施为
.
(2)保持容器体积不变,反应时间(t)与容器内气体总压强(p)的数据见下表,回答下列问题:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①由平衡时总压强P和起始压强P
0,计算反应物A达到平衡时的转化率为=
(用P、P
0表示);达到平衡时吸收的热量为
kJ(用P、P
0、Q表示)
②下表为反应物A浓度与反应时间的数据(浓度只保留到三位有效数字).分析该反应中反应物的浓度
c(A)变化与时间间隔(△t)的规律,得出的结论是
,由此规律推出反应在12h时反应物的浓度c(A)为
mol?L
-1.
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol?L-1) | 0.100 | 0.0508 | 0.0254 | 0.00635 |
(3)把密闭容器保持恒温恒容充入0.10molA(g)设为条件 I;把密闭容器保持恒温恒压充入0.20molA(g)设为条件 II.则达平衡时,则A体积分数:I
II (填“<”、”“<”或“=”)



 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下: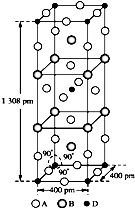 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: