
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
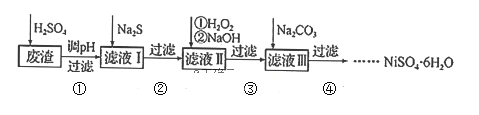
已知:①![]() 是一种不溶于水易溶于强酸的沉淀;②已知
是一种不溶于水易溶于强酸的沉淀;②已知![]() ,
,![]() 的
的![]() 。
。
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是___________。若在![]() 时,调pH=4除去铁,此时溶液中
时,调pH=4除去铁,此时溶液中![]() ______________。
______________。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是_ ___(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
【答案】第四周期,第Ⅷ族 H-O-O-H Cu2++ S2-=CuS↓ 避免生成H2S,影响除杂 防止H2O2受热分解 2.64![]() 10-9mol/L AE
10-9mol/L AE
【解析】
本题将工艺流程与氧化还原、电解池、沉淀溶解平衡相互结合,第一步操作为溶解金属,第二步为除去Cu2+和![]() ,第三步除去Fe和Cr,最后得到
,第三步除去Fe和Cr,最后得到![]() ,在各个步骤中结合氧化还原等一些应用。
,在各个步骤中结合氧化还原等一些应用。
(1)根据元素的排列规律及Ni的原子序数为28,可知Ni的位置为:第四周期第Ⅷ族;H2O2为分子晶体,原子之间均以共价单键相连,故的结构式为:H-O-O-H;
故答案为:第四周期第Ⅷ族;H-O-O-H;
(2)S2-与Cu2+和![]() 结合可生成沉淀,所以用
结合可生成沉淀,所以用![]() 溶液的目的是除去Cu2+和Zn2+,则除去Cu2+的离子方程式为:Cu2++ S2-=CuS↓;S2-可与结合生成弱电解质H2S,所以前一步在调节溶液的pH不能太低,否则会生成杂质H2S,影响除杂;
溶液的目的是除去Cu2+和Zn2+,则除去Cu2+的离子方程式为:Cu2++ S2-=CuS↓;S2-可与结合生成弱电解质H2S,所以前一步在调节溶液的pH不能太低,否则会生成杂质H2S,影响除杂;
故答案为:Cu2++ S2-=CuS↓ ;避免生成H2S,影响除杂;
(3)步骤③除去Fe采用生成![]() 的方式,在第一步酸溶时,铁变成Fe2+,因此该处需要氧化剂,发生氧化还原反应,温度太高,氧化剂H2O2分解;由于存在沉淀溶解平衡:
的方式,在第一步酸溶时,铁变成Fe2+,因此该处需要氧化剂,发生氧化还原反应,温度太高,氧化剂H2O2分解;由于存在沉淀溶解平衡:![]() ,平衡常数
,平衡常数![]() ,已知pH=4,则
,已知pH=4,则![]() ,公式换算可得:
,公式换算可得:![]() ;
;
故答案为:防止H2O2受热分解;![]() ;
;
(4)用电解法制备高纯度镍,原理同于制备高纯度铜,粗镍做阳极,活泼金属在阳极放电,该处在阳极反应的金属有Fe、Zn, 失去电子生成Fe2+、Zn2+,Cu和Pt作为阳极泥,在电解槽的底部,阴极发生的电极反应式为:![]() ,虽然阴极阳极都是2e-,但Fe、Zn和Cu本身的质量不一样,所以阳极减少的质量不等于阴极生成的质量,所以选AE,
,虽然阴极阳极都是2e-,但Fe、Zn和Cu本身的质量不一样,所以阳极减少的质量不等于阴极生成的质量,所以选AE,
故答案为:AE。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
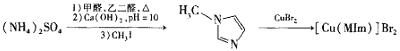
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与![]() 互为等电子体的阴离子为_______。
互为等电子体的阴离子为_______。
(3)![]() 中心原子的杂化方式为_________。
中心原子的杂化方式为_________。
(4)MIm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如图所示。

由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。
(6)Cu晶体的堆积方式为面心立方最密堆积,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查汽车酒驾的一种酸性燃料电池酒精检测仪工作原理如图所示,它适合现场吹气进行酒精检测。下列说法正确的是( )
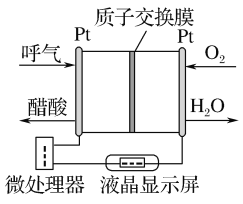
A.电流由呼气所在的铂电极流出
B.O2所在的铂电极处发生还原反应
C.O2得电子与H2O结合生成OH-
D.该电池的负极反应式为CH3CH2OH+3H2O-12e-===CO2↑+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含有少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
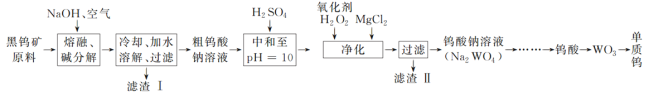
已知:①滤渣Ⅰ的主要成分是Fe2O3、MnO2;②上述流程中,钨的化合价只有在最后一步发生改变;③常温下钨酸溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为______,请写出FeWO4在熔融条件下发生碱分解生成Fe2O3的化学方程式:_____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子含有SiO32—、HAsO32—、HAsO42—等,则“净化”过程中,加入H2O2时发生反应的离子方程式为HAsO32—+H2O2===HAsO42—+H2O,滤渣Ⅱ的主要成分是________。
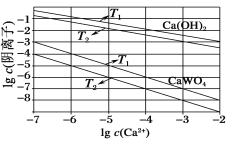
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度的升高而减小。如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则:
①T1_____T2(填“>”或“<”);T1℃时Ksp(CaWO4)=______。
②向钨酸钠溶液中加入石灰乳会得到大量钨酸钙,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜___________加入甲醛,且反应釜应装有________________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃由石英砂、___________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为______________。
(3)玻璃钢中玻璃纤维的作用是____________。玻璃钢具有__________等优异性能(写出两点即可)
(4)下列处理废旧热固性酚醛塑料的做法合理的是_____________
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
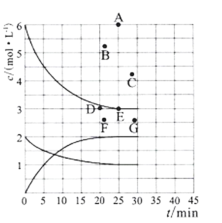
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
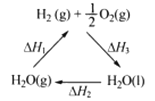
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。
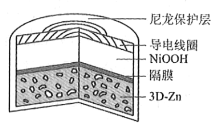
A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com