
【题目】已知H2(g)+I2(g)![]() 2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
A. 甲、乙提高相同温度
B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强
D. 甲增加0.1molH2,乙增加0.1molI2
科目:高中化学 来源: 题型:
【题目】下列反应中![]() H>0,
H>0,![]() S>0的是
S>0的是
A. 2Mg(s) + CO2(g)→ 2MgO(s) + C(s)
B. 低温下能自发进行的反应:NH3(g)+HCl(g) →NH4Cl(s)
C. 高温下能自发进行的反应:SiO2(s) +2C(s) →Si(s)+2CO(g)
D. 任何温度下均能自发进行的反应:2H2O2(l) → 2H2O(l) + O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B. 4.0 mol SO2+1.0 mol O2
C. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
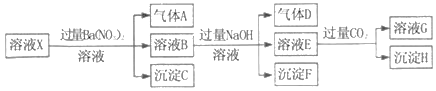
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①煤的干馏是____________(填“物理变化”或“化学变化”);
②乙烯分子中官能团的符号____________;
③葡萄糖的结构简式_______________;
④乙醇分子中官能团的电子式_________________;
(2)某反应体系中有反应物和生成物共六种:H2C2O4、CO2、(VO2)2SO4、VOSO4、H2SO4、H2O。完成并配平该反应的化学方程式_____________。
(3)已知铍与铝的化学性质相似,绿柱石是铍、铝的硅酸复盐,其化学式为Be3Al2Si6O18。写出绿柱石溶解于过量NaOH溶液的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
A. 甲和乙中反应的化学平衡常数相同
B. 乙和丙中的二氧化硫的生成速率相同
C. 乙中SO2的体积分数大于丙
D. 转化率:α甲(SO2)+α乙(SO3)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有1 mL浓硫酸的试管中加人5 mL 0 .1 mol/L的K2 Cr2 O7溶液 | 溶液橙 色变深 | 增大生成物浓度,平衡Cr2 O |
B | 向Mg(OH)2悬浊液中加人少量醋酸铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg2++2NH3·H2O |
C | 相同温度下,同时向①4mL0.1 mol/L. KMnO4),酸性溶液和②4 mL 0.2 mol/LKMnO4,酸性溶液中,分别加人4mL 1 mol/L. H2 C2 O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、研究NO2、SO2、CO等大气污染气体的处理具有重要意义
(1)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)
2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)![]() 2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)
2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
(2)上述反应达化学平衡的标志是_________________。
A.混合气体的总质量保持不变
B.混合气体的总压强保持不变
C.混合气体的平均相对分子质量保持不变
D.混合气体的颜色保持不变
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。

Ⅱ、甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
②:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_________________________。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为_____________。
②100℃时反应I的平衡常数为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com