
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
分析 A.含Fe2+的溶液、含低浓度的Cu2+的溶液、含低浓度的Cr3+的溶液均呈浅绿色;
B.不只是氢氧化亚铁是白色沉淀;
C.若原溶液中含有Fe3+而不含Fe2+,同样会出现溶液变红的现象;
D.先根据Fe3+的特征反应判断溶液不含Fe3+,然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在.
解答 解:A.溶液呈浅绿色,不一定含有Fe2+,也可能含有的是Cu2+或Cr3+,故A错误;
B.该溶液中加入NaOH溶液,生成白色沉淀,不一定说明该溶液中含有Fe2+,也可能含有Al3+、Mg2+等,故B错误;
C.先滴加氯水,若原溶液含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe2+,故C错误;
D.向溶液中滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再加入氯水,溶液变红,则说明滴入氯水后溶液中含Fe3+,则说明原溶液中含Fe2+,是滴入的氯水将Fe2+氧化为Fe3+,故D正确;
故选D.
点评 本题考查离子的检验,明确离子的特征反应是解题关键,注意滴加氧化剂、KSCN溶液的顺序不能颠倒,如果颠倒,无法确定溶原液将中是否含有Fe3+,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热为285.8 KJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
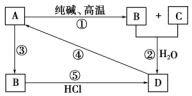 已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.
已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com