
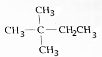
 (2)
(2)
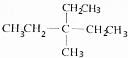 (4)
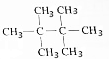
(4)
科目:高中化学 来源: 题型:选择题
| A. | 甲基戊烷也称为新戊烷 | B. | 由苯制取溴苯的反应属于加成反应 | ||
| C. | C2H4Br2有2种同分异构体 | D. | 乙醇和乙酸均为非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴到NaOH溶液中,一制取氢氧化铁胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解质溶液为碱性溶液,阳离子向正极移动 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
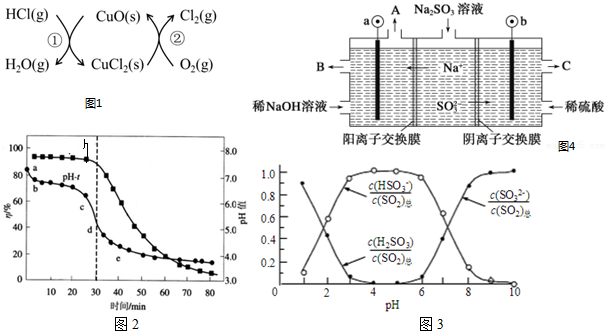
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com