
| A. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| C. | 玛瑙的主要成分是二氧化硅,陶瓷的主要成分是硅酸盐 | |
| D. | 豆浆制豆腐、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体的性质 |
分析 A.氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3;
B.铝热反应是放热反应;
C.玛瑙的主要成分是二氧化硅,陶瓷是由黏土烧制而成的;
D.分散质粒子直径在1nm~100nm之间的分散系属于胶体.
解答 解:A.氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,氧元素化合价降低,体现氧化性,故A正确;
B.高温下铝与氧化铁反应是放热反应,碳酸钙分解、氢氧化钡晶体和氯化铵固体反应是吸热反应,故B错误;
C.玛瑙的主要成分是二氧化硅,陶瓷是由黏土烧制而成的,黏土的成分是硅酸盐,则陶瓷的主要成分是硅酸盐,故C正确;
D.蛋白质、塑料、橡胶及合成纤维等高分子化合物分子大小1nm~100nm之间,所以在豆浆制豆腐、纳米材料的制备,塑料、橡胶及合成纤维等的制造过程都会用到胶体的性质,故D正确.
故选B.
点评 本题考查氧化还原反应、放热反应、材料以及胶体等知识,题目难度不大,侧重基础知识的考查,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 目前使用的燃料液化石油气,其主要成分均属于烯烃 | |
| B. | 食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 | |
| C. | 用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
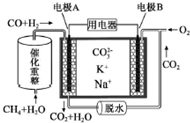
| A. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| B. | 电极A上CO参与的电极反应为:CO+CO32--2e-═2CO2↑ | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油是纯净物,乙醇汽油是混合物 | |
| B. | 苯、乙烯、乙酸和乙酸乙酯都能发生加成反应 | |
| C. | 石油的分馏和煤的干馏都发生了化学变化 | |
| D. | 除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-离子的溶液中,一定有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com