
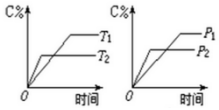
 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
分析 T2达到平衡时间短,温度较高,而C%含量低,则正反应方向放热,P2达到平衡时间短,压强较大,而C%含量低,则n<e+f,催化剂不影响平衡移动,据此判断.
解答 解:T2达到平衡时间短,温度较高,而C%含量低,则正反应方向放热,P2达到平衡时间短,压强较大,而C%含量低,则n<e+f,催化剂不影响平衡移动,
A、达平衡后,若升温,正反应是放热反应,所以K减小,故A正确;
B、使用催化剂平衡不移动,C%不变,故B错误;
C、P2达到平衡时间短,压强较大,而C%含量低,则n<e+f,故C错误;
D、达平衡后,若增加A的量,平衡不移动,所以B的转化率不变,故D错误;
故选A.
点评 本题考查化学平衡图象、影响平衡的因素、影响因素等,难度不大,注意掌握平衡移动原理,根据图象判断温度和压强对平衡移动的影响.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2在常温下是气体,SiO2在常温下是固体 | |
| B. | C、Si、Ge的最外层电子数都是4,次外层电子数都是8 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | 该族元素的主要化合价是+4和+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应水化物能与其气态氢化物反应生成盐 |
| W | 原子的M电子层上有3个电子 |
| X | 在短周期元素中,其原子半径最大 |
| Y | 最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成Y的单质和H2O |
| Z | 元素最高正价与最低负价的代数和为6 |
| A. | M、Y、Z的简单离子半径依次增大 | |
| B. | W与Z形成的化合物属于离子化合物,其水溶液显酸性 | |
| C. | 化合物X2Y2、Y2Z2的晶体类型相同,化学键类型也相同 | |
| D. | M、W、X的最高价氧化物对应水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L NH4NO3溶液中含有铵根离子数目为0.1NA | |
| B. | 标准状况下,22.4 L SO3中含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L氯气与含有1 mol FeI2的溶液反应时,转移的电子数为2NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
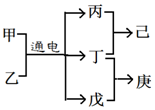 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )| A. | 原子半径Z>Y>X | |
| B. | 仅由这四种元素构成的溶液可能呈酸性、碱性或中性 | |
| C. | 己为由极性键构成的非极性分子 | |
| D. | 戊为一元弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
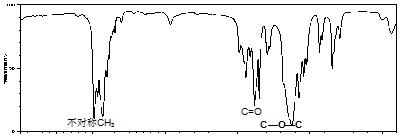
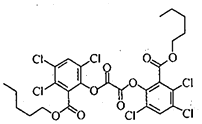 荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )
荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )| A. | 分子中含有一种含氧官能团 | |
| B. | 苯环上的一溴代物只有一种 | |
| C. | 可以发生取代反应和加成反应 | |
| D. | lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 海水中提溴的过程不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com