
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 先根据含氧量和相对分子质量的范围,得出氧原子数,然后根据氧元素的质量分数求得有机化合物的相对分子质量,进而计算化学式,最后确定结构.
解答 解:碳和氢的质量分数之和为51.52%,则氧的质量分数为48.48%,由有机化合物的相对分子质量大于110,小于150,所以氧原子个数大于$\frac{110×0.4848}{16}$=3.33,小于$\frac{150×0.4848}{16}$=4.55,即氧原子为4个,所以有机物分子质量=$\frac{4×46}{0.4848}$=132,其中C、H的相对原子质量之和为132-16×4=68,由余商法$\frac{68}{14}$=4…12,可确定分子式为C5H8O4,C5H8O4与不饱和度为2,所以分子中最多含有2个羰基官能团,
故选A.
点评 本题主要考查有机物分子式和结构的确定,计算氧原子数、确定分子式为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸可以和大理石反应 | |
| B. | 氢氧化铁沉淀可溶于硝酸 | |
| C. | 分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟 | |
| D. | 铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中第3列的元素种类数最多 | |
| B. | 金属性最强的元素位于元素周期表的第1列 | |
| C. | 非金属性最强的元素位于元素周期表的第17列 | |
| D. | 能形成化合物的种类数最多的元素位于元素周期表的第16列 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
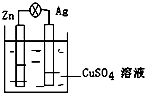 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2(g)+O2(g)=2H2O(g)△H1 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1 C(s)+O2(g)=CO2 (g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S原子结构示意图: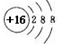 | |
| B. | 二氧化碳的电子式: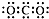 | |
| C. | H、D、T表示同一种核素 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com