
X、Y、Z为三种气体。把a mol X和b mol Y充入一密闭容器中。
发生反应X+2Y  2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
A.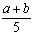 ×100% B.
×100% B. ×100% C.
×100% C. ×100% D.
×100% D. ×100%
×100%
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于影响化学反应速率因素的解释不正确的是
A.若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大
B.若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大
C.若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高 →有效碰撞次数增多→化学反应速率增大
D.若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:
 mA(g) + nB(g) pC(g) ∆H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
mA(g) + nB(g) pC(g) ∆H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
A.T1 <T2 P1>P2 m+n<P Q<0 B.T1>T2 P1<P2 m+n>P Q>0
C.T1<T2 P1<P2 m+n<P Q>0 D.T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
(2)3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
(3)Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德常数,下列说法正确的是
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com